Kemi
mængdeberegninger - molarmasse for lightergas
Hej!
Jeg skal snart til eksamen i kemi. Jeg sidder og læser mine rapporter igennem, og kan pludselig ikke huske, hvordan jeg har gjort i mine beregninger.
Jeg skal finde stofmængden for lightergassen, vha idealgasloven.
Da trykket jo afhænger af temperaturen, skal jeg derfor finde trykket i bar for temperaturen. Jeg har skrevet således " Da vores vand havde en temperatur på 26 grader celcius, skal vi lægge 0,0034 til trykket ved temperaturen for 24 grader: 0,0298 bar + 0,0034 bar = 0,0332 bar.
For at beregne lightergassen tryk, trækkes vanddampens tryk fra trykket, som er målt på skolens barometer, dvs. 1,015 bar. "
herved fik jeg 1,015-0,0332 = 0,9818 bar.
Mit spørgsmål er: hvorfor lægges 0,0034 bar til 0,0298 bar? ( 0,0298 bar må være trykket ved de 24 grader - men hvordan vides dette?) Og hvad er de 0,0034 bar, siden de lægges til? Jeg kan simpelthen ikke huske, hvorfor jeg har gjort, som jeg har gjort. Håber virkelig, at nogen kan hjælpe mig :)
Venlgie hilsner
Svar #1
07. august 2016 af BadBoyBard (Slettet)
Jeg har nu ikke læst din rapport igennem, men hvad jeg tror, du mener, er at:
De 0,0298 bar er trykket ved 24 grader celcius. Men eftersom vores vand havde en temperatur på 26 grader celcius, kan vi logisk forvente, at trykket er højere, da der er en sammenhæng mellem temperatur og tryk. Derfor skal vi lægge den marginale stigning i trykket, der dannes via den 2 grader celcius stigning i temperatur, som vi har beregnet til 0,0034 bar via XYZ formel, til de orginale 0,0298 bar.
Derfor er de 0,0034 bar, du har, blot et udtryk for den marginale stigning i tryk du får på grund af en stigning fra en 26 *C - 24 *C = 2 *C stigning i temperatur.
Hvad jeg skrev foroven er ren spekulation, da jeg jo ikke har læst din rapport. Men jeg haaber at det kan hjælpe dig på vej, eller i hvertfald opfriske din hukommelse.
Mvh
B
Svar #2
07. august 2016 af Manu0407 (Slettet)
Tak for svar! Det er præcis det jeg mener! :) Men jeg har ikke selv beregnet de 0,0034 bar - det var blot min lærer, der sagde, at vi skulle lægge dem til. Har du måske mulighed for at forklare mig, hvordan man beregner dette?
Svar #3
07. august 2016 af BadBoyBard (Slettet)
Ah, okay. Hvis du ikke selv har beregnet de 0.0034 bar, så kunne du nøjes med at skrive, at du har fået dette som information fra "XYZ" kilde, her din lærer, som du "anser som værende troværdig".
Jeg tør ikke sige, hvordan din lærer har beregnet dette tal, Manu0407, eftersom jeg ikke kender personen, så det jeg kommer med forneden er ren spekulation.
Har du set denne formel før i dine matematik-fysik bøger?
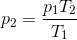
Du ved jo, at der er en positiv, proportional sammenhæng mellem tryk og temperatur. Dvs., at temperaturen forventes at stige, når trykket stiger, osv. Hvad jeg tror din lærer har gjordt er at finde trykket (p2) ved de 26 grader (T2) udefra formlen foroven, (da han jo kender både T1, T2, og p1), trukket p1 fra p2 (altså p2 - p1), og dette burde så give de 0,0034 bar, du fik. Men som sagt, så er jeg er ikke sikker, da jeg ikke selv har skrevet reporten eller deltaget i jeres laboratorietimer.
Hvornår er din examen? Hvorfor prøver du ikke at sende en mail til din lærer, hvis du altså stadig har tid?
Mvh
B
Svar #4
07. august 2016 af Manu0407 (Slettet)
Svar #5
07. august 2016 af BadBoyBard (Slettet)
Helt fint -- selv tak og held og lykke med din examen!
Skriv et svar til: mængdeberegninger - molarmasse for lightergas
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

