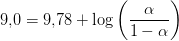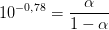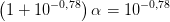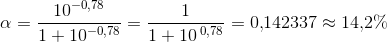Kemi
Amfolytligning
11. november 2016 af
Fatima786
-
Niveau: Universitet/Videregående
Hej, nogen der kan forklare hvordan man får den del der er farvet???
Beregn hvor stor en brøkdel der findes på formen H+(gly)– ved pH=9,0... pKa2 =9,78
Henderson-Hasselbach: pH = pKa2 + log([(gly)–]/[H+(gly)–])
9,0 = 9,78 + log([(gly)–]/[H+(gly)–])
[(gly)–]/[H+(gly)–] = 10^–0,78
Brøkdel på [H+(gly)–] = 1/(1+0,166) = 0,85766 = 86%
takker
Skriv et svar til: Amfolytligning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.