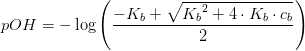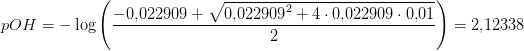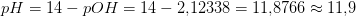Kemi
Titrering
Hej,
Jeg sidder og kæmper med nogle opgaver, men bliver ved med at få et forkert resultat. Opgaven lyder:
100 mL opløsning af 0,0100 M fosforsyre titreres med 1,00 M NaOH. Hvor mange mL titrator (NaOH) er der tilsat fosforsyre opløsningen, når pH er lig med pKa(H3PO4); lig med pKa(H2PO4-); lig med pKa(HPO42-)? Antag at alle tre syrer anses som monoprotiske syrer.
De forskellige pKa værdier lyder således:
H3PO4 = 2,12
H2PO4- = 7,21
HPO42- = 12,67
Mange tak på forhånd :)
Svar #1
06. april 2017 af mathon
I det følgende ses bort fra den ringe volumenforøgelse ved tilsætning af titrator:
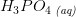 anskuet monoprotisk:
anskuet monoprotisk:
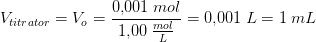
hvoraf
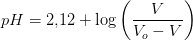
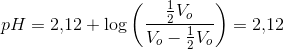
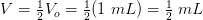
Svar #2
06. april 2017 af mathon
…og så fremdeles:
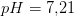 kræver samlet tilsætning af
kræver samlet tilsætning af 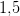 mL titrator.
mL titrator.
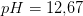 kræver samlet tilsætning af
kræver samlet tilsætning af 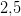 mL titrator.
mL titrator.
Svar #3
06. april 2017 af A1367
Tusind tak. Det virker jo meget simpelt, men jeg er lidt usikker omkring konklusionen af det hele. Hvordan opnår du at springe fra ligningen med pH til at konkludere at V blot er det halve af V0 i det første tilfælde?
Svar #5
06. april 2017 af A1367
Ja, det er bare mig som kludrer i det på lommeregneren, da jeg prøvede det. Tak for tålmodigheden. Der er et andet delspørgsmål, som jeg også har problemer med. Det lyder:
100 mL opløsning af 0,0100 M fosforsyre skal titreres med 1,00 M NaOH. Hvad er pH ved ækvivalenspunktet for H3PO4; ækvivalenspunktet for H2PO4-; ækvivalenspunktet for HPO42-?
Er det så at finde ækvivalenspunktet for de tre, og herefter benytte samme formel som før eller? Jeg brugte en anden formel tidligere. Jeg er tæt på det rigtige svar, men at være tæt på er jo ikke godt nok.
Skriv et svar til: Titrering
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



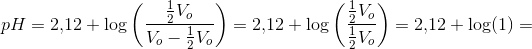
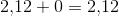
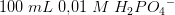 som er en svag syre:
som er en svag syre: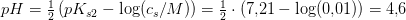
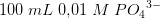 som er en middelstærk base med pKb = 1,64 Kb = 0,022909
som er en middelstærk base med pKb = 1,64 Kb = 0,022909