Ækvivalent
Ordet ækvivalent betyder ifølge den danske ordbog: ’noget, der svarer til eller stemmer overens med noget bestemt’. Det er indenfor kemi en meget passende definition, og i de følgende afsnit vil et par af de begreber, hvor ordet indgår, blive forklaret.
Olieækvivalent
Først og fremmest anvendes ækvivalent til sammenligninger og til omregning af enheder. Et eksempel på dette er olieækvivalenter for råolie. Dette er en enhed for energi, idet 1 kg olieækvivalenter angiver brændværdien af 1 kg råolie, altså den energi der frigives ved afbrænding af 1 kg råolie. Brændværdien er i dette tilfælde lig med 41,9 mega Joule (MJ). Det vil sige, for hver gang man har 41,9 MJ, kunne man lige så godt angive denne mængde energi som 1 kg olieækvivalenter. 1 liter fyringsolie har en brændværdi på 36,0 MJ.
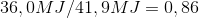
Altså svarer en liter fyringsolie til 0,86 kg olieækvivalenter. Man kan også sige, at 1 liter fyringsolie er energisk ækvivalent med 0,86 kg råolie. Det er samme tankegang, der ligger bag 


Ækvivalente mængder
Ækvivalente mængder er en betegnelse, der anvendes i forbindelse med kemiske reaktioner. Man siger, at man har ækvivalente mængder, når der ikke er overskud af nogen stoffer i en reaktion. Det vil sige, når forhold mellem stofmængderne af forbindelserne er lig med forholdet mellem forbindelsernes koefficienter i det afstemte reaktionsskema. Nedenfor ses to eksempler på kemiske reaktioner.
(1) 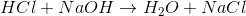
(2) 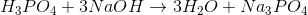
I reaktion 1 forbruges der 1 mol saltsyre (HCl) for hvert mol natriumhydroxid (NaOH), og derfor har man i reaktion 1 ækvivalente mængder, når der er lige mange mol af hver af de to stoffer (således at det hele forbruges i reaktionen). I reaktion 2, derimod, forbruges der 3 mol natriumhydroxid for hvert mol phosphorsyre 
Ækvivalenspunkt
Ækvivalenspunktet angiver det tidspunkt i en titrering, hvor stofmængden af titranden er lig stofmængden af titratoren. Ser vi på et eksempel, hvor natriumhydroxid titreres med saltsyre, så vil ækvivalenspunktet være det punkt, hvor der er tilsat præcis lige så mange molekyler natriumhydroxid til blandingen, som der var saltsyre molekyler fra start. Man kan sige, at ækvivalenspunktet er netop det tidspunkt, hvor der haves ækvivalente mængder af de to forbindelser. Det er dog vigtigt at vide, at forbindelser, der kan afgive flere protoner 

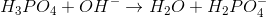
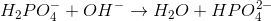
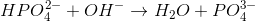
De tre ækvivalenspunkter nås, når der er ækvivalente mængder af forbindelserne i de tre forskellige reaktionsligninger. Af denne grund ligger ækvivalenspunkterne for titrering af 1 mol phosphorsyre med natriumhydroxid altså efter tilsætning af hhv. 1 mol, 2 mol og 3 mol natriumhydroxid.

