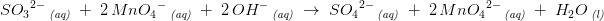Kemi
Afstemning af redoxreaktion
Hej. Jeg har problemer med afstemningen af redoxreaktionen:
SO3(2-) + MnO4(1-) --> SO4(2-) + Mn(2+)
Oxidationstal:
SO3(2-) = 4
MnO4(1-) = 7
SO4(2-) = 5
Mn(2+) = 2
Og så sættes der koefficienter på som gjort nedenfor, men jeg forstår simpelthen ikke hvordan man har fundet disse koefficienter? I min bog står der at man skal sætte koefficienter på således den samlede stigning bliver lige så stor som det samlede fald i oxidationstal. Men jeg forstår simpelthen stadig ikke hvordan man kommer frem til disse koefficienter?:
5SO3(2-) + 2MnO4(1-) --> 5SO4(2-) + 2Mn(2+)
Svar #1
30. marts 2011 af vejgeh (Slettet)
Hmm, jeg ville ikke bruge de koefficienter.
Fra venstre side over til højre side går Mn 5 ned i oxidationstrin, ikke sandt? Samtidig går S 2 op (oxidationstallet i SO42- er ikke 5, det er 6). Husk at det er ændringen du skal bruge til noget. Når man har disse to tal, passer det altid hvis du bruger dem som koefficienter.
Tænk logisk: S donerer 2 elektroner til Mn, og hvert Mn modtager 5 elektroner. Derfor skal du jo selvfølgelig bruge 2½ S for at reducere Mn fra 7 til 2, og da man ønsker at have hele koefficienter bliver hele reaktionen ganget med to, så du får hhv. 2 og 5.
Hjalp det?
Svar #2
30. marts 2011 af mathon
antal opgange skal være lig antal nedgange per atom
dvs
op ned antal produkt
S 2 5 10
Mn 5 2 10
Svar #3
30. marts 2011 af osterejer (Slettet)
#1
Hmm, jeg ville ikke bruge de koefficienter.
Fra venstre side over til højre side går Mn 5 ned i oxidationstrin, ikke sandt? Samtidig går S 2 op (oxidationstallet i SO42- er ikke 5, det er 6). Husk at det er ændringen du skal bruge til noget. Når man har disse to tal, passer det altid hvis du bruger dem som koefficienter.
Tænk logisk: S donerer 2 elektroner til Mn, og hvert Mn modtager 5 elektroner. Derfor skal du jo selvfølgelig bruge 2½ S for at reducere Mn fra 7 til 2, og da man ønsker at have hele koefficienter bliver hele reaktionen ganget med to, så du får hhv. 2 og 5.
Hjalp det?
Har desværre enormt svært ved at forstå det her...
Jeg forstår ikke hvorfor du siger at S (hvorfor ikke SO3(2-)?) donerer 2 elektroner til Mn (mener du Mn(2+)?) - min lære har lavet en pil som går fra SO3(2-) til SO4(2-) - altså at der bliver afgivet 2 elektroner fra SO3(2-) til SO4(2-)?
Desuden så går der også en pil fra MnO4(-) til Mn(2+) - hvad mon pilene betyder?
Du siger at du ikke vil bruge de koefficienter som jeg har brugt, men jeg har: 5SO3(2-) + 2MnO4(1-) --> 5SO4(2-) + 2Mn(2+) fra min lære så det burde vel være rigtigt?
- hvis nogen kan udpensle hvordan man finder frem til de her koefficienter så vil det virkelig være til stor hjælp
Svar #4
30. marts 2011 af vejgeh (Slettet)
Undskyld - koefficienterne er jo selvfølgelig de samme, som jeg også har skrevet til allersidst.
Pointen er, når jeg skriver S går to op i oxidationstal er, at det netop er svovl-atomet, som afgiver elektroner, og en konsekvens heraf er så at SO32- bliver til SO42-. Der bliver ikke afgivet to elektroner fra SO32- til SO42- som du siger. Pointen med pilene er at at vise at svovl-atomet i reaktionen går fra at være sulfit (SO32-) til sulfat (SO42-), men dette betyder IKKE at svovl overfører elektroner til et andet svovl.
I SO32- er svovl i oxidationstal +4, men afgiver to elektroner, så det får oxidationstal +6. Som en konsekvens heraf binder det et ekstra ilt-atom og bliver dermed til SO42-.
Tilsvarende kan mangan-atomet i MnO4- (som er i oxidationstal +7) optage fem elektroner, så det kommer i oxidationstal +2 i stedet (derfor Mn2+).
Altså afgiver hvert svovl to elektroner,og hvert mangan optager fem. For at det skal kunne passe, skal du benytte lige netop de to tal (2 og 5) som koefficienter i din reaktion.
Er den stadig helt gal?
Svar #5
30. marts 2011 af osterejer (Slettet)
Okay, det øverste forstod jeg godt, men:
"Tilsvarende kan mangan-atomet i MnO4- (som er i oxidationstal +7) optage fem elektroner, så det kommer i oxidationstal +2 i stedet (derfor Mn2+)"
Men hvorfor er det at du lige bruger tallet 2?
Super mange gange tak for hjælpen!
Svar #6
30. marts 2011 af vejgeh (Slettet)
Når man siger at MnO4- indeholder mangan i oxidationstal +7, kan det skrives som Mn(VII). Det betyder så at mangan-atomet har en ladning på +7. Hvordan ved vi, at det er oxidationstrin +7? Jo - den ion, som atomet medvirker i hedder MnO4-, og vi ved at O (næsten) altid er -2, og da ionen har en samlet ladning på -1, er den eneste mulighed at Mn har ladningen +7.
På samme måde har sulfat-ionen 4 O-atomer, som hver har ladningen -2. Sulfationen har en samlet ladning på -2, hvilket gør at S-atomet logisk set på have en ladning på +6.
Når jeg skriver Mn2+ kan man direkte se, at mangan-atomet er i oxidationstrin +2, fordi der ikke indgår andre atomer (fx. O) i ionen. I sådanne situationer kan man aflæse en atoms oxidationstrin direkte ud fra ionens ladning, fordi ionen simpelthen kun består af et atom.
Svar #8
30. marts 2011 af osterejer (Slettet)
Endnu engang tak vejgeh! Nu tror jeg faktisk jeg forstår det hele. Godt at man kan få hjælp selvom man er lidt doof engang imellem hehe :)
Svar #9
08. marts 2017 af HFNU (Slettet)
1SO32- (aq) + 2MnO4- → 1SO42- + 2MnO42-
Er der en som vil hjælpe mig med hvordan jeg afstemmer med OH?- eller H+ ?og hvordan jeg bagefter afstemmer med H ved at tilføje H2?O
Svar #11
08. marts 2017 af HFNU (Slettet)
Tak er tilstandsformerne sådan som du har skrevet det hele vejen igennem alle tre trin i forsøget. Ved du det?
Skriv et svar til: Afstemning af redoxreaktion
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.