Kemi
Salpetersyre-opløsning med en pH-værdi på 4,74.
Jeg skal aflever opgaven men kan ikke lave den. Er der nogen som kan hjælpe mig?
Du har en salpetersyre-opløsning med en pH-værdi på 4,74.
a) Beregn den formelle koncentration af salpetersyre-opløsningen.
Du afvejer 31,7 gram bariumhydroxid-octahydrat og opløser det i vand til et slutvolumen på 1,50 L.
b) Vis ved beregning, at den formelle koncentration af bariumhydroxid-opløsningen er 0,0670 .
c) Beregn den aktuelle koncentration af barium-ioner og af hydroxid-ioner i opløsningen.
d) Beregn bariumhydroxid-opløsningens pH.
Du blander ækvivalente mængder af salpetersyre-opløsningen og bariumhydroxid-opløsningen.
e) Opskriv et afstemt reaktionsskema for reaktionen, der finder sted ved
sammenblandingen. Hvilken type reaktion er der tale om?
Svar #1
17. oktober 2014 af OliverGlue
a) pH=-log10(c), dv.s. c=10^-4.74=0.000018
b) M=315,47 g/mol, dv.s. 31.7/((315.47)*(1.5))=0.0670mol/L
c) Du får en barium ion og 2 hydroxid ioner per bariumhydroxid.
d) Den dobbelt koncentration af b), altså pH=-log10(2*0.0670)=0.87
e) 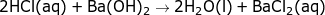
Skriv et svar til: Salpetersyre-opløsning med en pH-værdi på 4,74.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.