Kemi
Barium og strontiumcarbonat pH eddikesyre
Hej, jeg håber, der er nogle kloge knolde derude et sted, ihvertfald med henblik på uorganisk kemi.
Opgaven lyder..
BaCO3 og SrCO3 opløses i 4 M eddikesyre. Antag, at halvdelen af eddikesyren er forbrugt ved opløsningsprocessen.
1) Opskriv reaktionen
BaCO2 (s) + 2CH3COOH (aq) <=> Ba(CH3COO)2 (aq) + H2O (l) + CO2 (g)
2) Beregn pH af opløsningen
Er det noget med dissociationskonstanter? I så fald så kan én måske forklare det pænt for mig :-) ?
Svar #1
07. november 2015 af mathon
BaCO3 (s) + 2 HAc (aq) 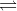 BaAc2 (aq) + H2O (l) + CO2 (g)
BaAc2 (aq) + H2O (l) + CO2 (g)
og
SrCO3 (s) + 2 HAc (aq) 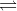 SrAc2 (aq) + H2O (l) + CO2 (g)
SrAc2 (aq) + H2O (l) + CO2 (g)
af pufferligningen:
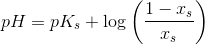
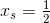
har man:
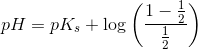
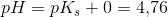
Svar #2
07. november 2015 af kattemad24 (Slettet)
Mange tak for det hurtige og grundige svar mathon! :-)
Skriv et svar til: Barium og strontiumcarbonat pH eddikesyre
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



