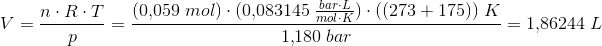Kemi
Idealgasloven, hjælp
Hej.
Jeg har fået disse spørgsmål:
1.
Beregn ud fra idealgasloven, hvor meget den dannede stofmængde CO2 (g) fylder. Antag at tempreaturen er 175 grader og trykket er 1,180 bar.
Spørgsmålene tager udgangspunkt i at CO2, som har 0,059 n i reaktionen.
Jeg har sat det op sådan her, men synes det lyder helt forkert?
V=(0,059x0,0831x448)/(1,180)=1,86
2.
Vi antager vi skal anvende den pågældende mængde natron i en kage (1 teskefuld er ca. 3-5 g). Stemmer det med hvor meget en kage normalt hæver?
Svar #3
09. december 2015 af mathon
Det er ikke korrekt, før enhederne er med ( men meningen var god nok ).
Svar #5
20. oktober 2018 af Sodiom
Jeg får det til følgende (har stofmængden 0.021605 mol i den reaktio reaktion, der var den rigtige reaktion):
V=((0.021605mol)*(0.0831R)*(448K))/1.180 bar = 6.8203 g
Dette betyder også, at mit resultat næsten stemmer overens med, at der normalt i en kage bliver brugt 3-5 gram natron.
Skriv et svar til: Idealgasloven, hjælp
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.