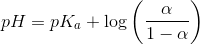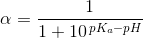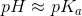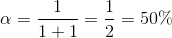Kemi
pKa, pH og ionisering
Goddag derude,
Et nok relativt dumt spørgsmål herfra, men kemi A er mig langt væk (læser på universitetet) og følgende problemstilling er netop poppet op i forbindelse med et farmakologisk pensum.
Hvordan er det nu sammenhængen mellem pKa for et stof, pH i opløsningen og ioniseret/uioniseret er?
Vil et stof hvis pKa er nær en opløsnings pH, være ioniseret eller uioniseret?
For at sætte det i kontekst, handler det om renal udskillelse af lægemidler, og denne udskillelse øges, såfremt stoffet er ioniseret (svært for nyrerne at reabsorbere).
Håber der er nogen der kan kaste lys over land, det holder mig (næsten) vågen om natten.
Skriv et svar til: pKa, pH og ionisering
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




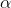 er ioniseringsgraden
er ioniseringsgraden