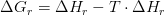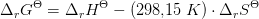Kemi
Termodynamik
26. december 2016 af
pige5
-
Niveau: Universitet/Videregående
Jeg har en opgave, som jeg ikke kan finde ud af, hvordan man løser. Den lyder på:
For reaktionen ADP + Pu --> ATP + H2o gælder at...
Svaret er: Reaktionen forbruger energi og deltaG = 7,3 kJ/mol.
Hvordan kommer man frem til dette?
Skriv et svar til: Termodynamik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.