Kemi
EDTA og orbitaler
Hej alle
Jeg har fået et eksamensspørgsmål hvor jeg skal gøre rede øvelsen vandets hårdhed.
Spørgsmålet og teorien handler om kompleksdannelser og orbitaler. Jeg kan ikke se hvor det er jeg skal hen med dette. Kan ikke koble de to ting med hinanden, altså forklare mig ud af hvorfor viden om orbitaler er vigtig for øvelsen. Har i en ide ?
Svar #1
13. juni 2018 af Heptan
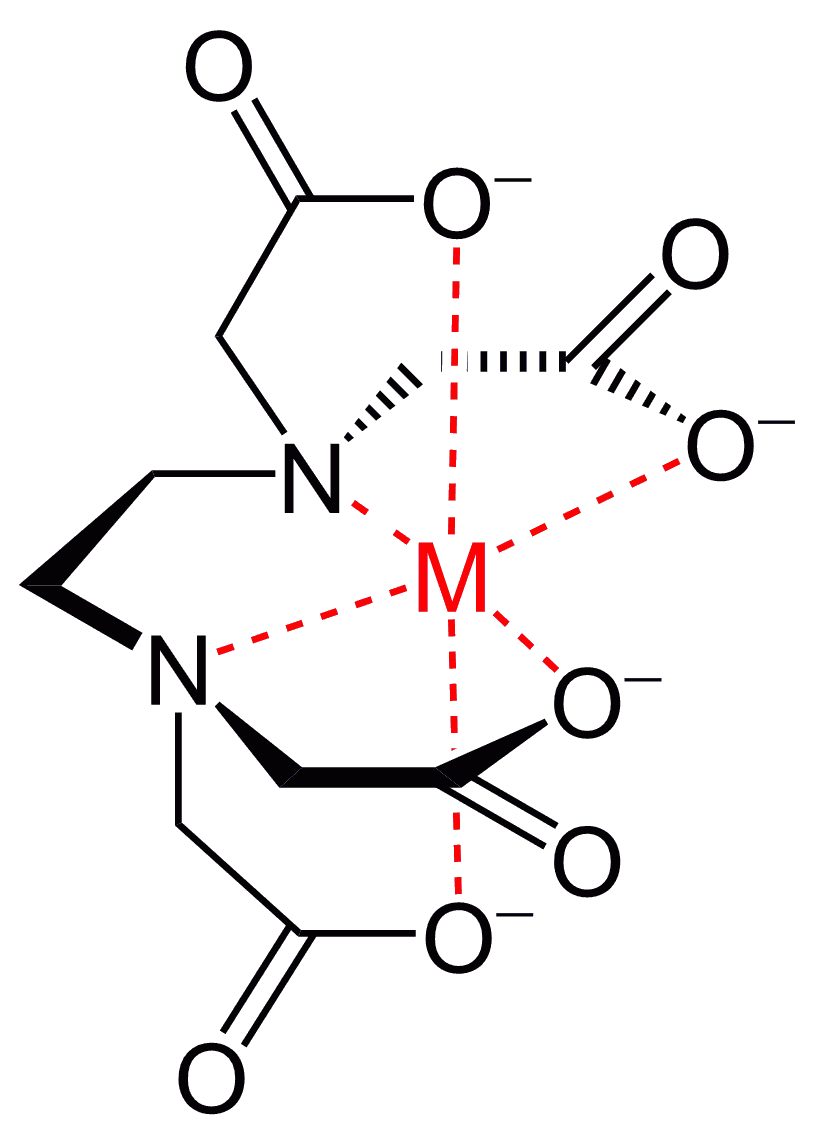
Vand er hårdt fordi det indeholder metalioner. Metalioner har orbitaler som kan danne dativ-kovalente bindinger med ligander. EDTA (figur til højre) er en meget speciel ligand fordi den kan binde hele 6 gange til en metalion (derfor kaldes den for en chelat ligand). At den kan lave 6 bindinger betyder at den termodynamisk kan udkonkurrere vand som ligand, fordi binding giver en stigning i entropi ("uorden").
Med orbitalteori kan man forklare at opsplitning af de tomme d-orbitaler er energi-favorabelt, idet koordinationen er en oktaeder, og metalionens ladning bliver stabiliseret osv.
Skriv et svar til: EDTA og orbitaler
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


