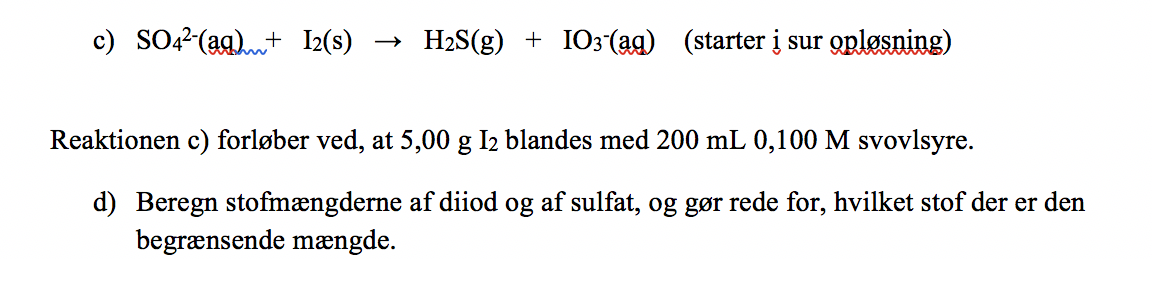Kemi
redoxreaktioner
03. oktober 2018 af
filealis (Slettet)
-
Niveau: B-niveau
???
Vedhæftet fil: Skærmbillede 2018-10-03 kl. 16.23.51.png
Svar #4
03. oktober 2018 af filealis (Slettet)
men jeg skal finde volumenet, skal jeg så ikke sige v=c·n
Skriv et svar til: redoxreaktioner
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.