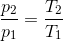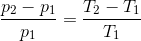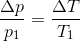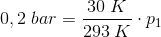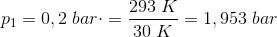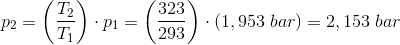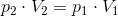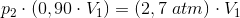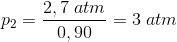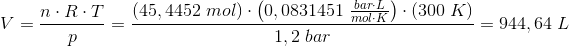Fysik
Tryk og gasser
Hej Alle.
En som har mulighed for, at hjælpe mig med følgende tre opgaver i fysik? Det omhandler gassers fysik med brug af Gay-Lussacs og Boyle-Mariottes love. Har prøvet i en evighed og kan ikke finde noget rigtig logisk løsning til dem. Det er følgende 3 opgaver jeg kæmper med:
Opgave 2 (svær)
En gasmængde med konstant volumen, får en temperaturstigning fra 20 °C til 50 °C, hvorved trykket forøges med 0,2 bar.
Find gassens tryk ved både 20 °C og 50 °C.
Opgave 3 med Boyle-Mariottes lov
Trykket i en beholder er 2,7 atm.
Beregn trykket i beholderen ved en 10% volumenformindskelse ved konstant temperatur.
Opgave 4 med idealgasligningen
Hvor stort er rumfanget af 2 kg CO2, der har et tryk på 1,2 bar og en temperatur på 27 °C?
Skriv et svar til: Tryk og gasser
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.