Kemi
opløselighed
Jeg har brug for hjælp med den vedhæftede opgave
Svar #1
03. april 2015 af Heptan
Svar #2
06. april 2015 af ghdfir (Slettet)
[SO4-]=0.01540 M
[Ag+]=2*0.01540 M
L=[Ag+]^2*[SO4-]=(2*0.0154)^2*0.0154=1.46*10^-5 M^3. Kan det passe?
Svar #3
06. april 2015 af ghdfir (Slettet)
Mit problem i anden del er at jeg ikke forstår hvad kompleksdannelseskonstanten er.
Svar #4
06. april 2015 af Heptan
#2 Ja, har ikke regnet efter, men det er skrevet rigtigt op.
#3 Det er ligevægtskonstanten for reaktionen:
![Ag^++2\ NH_3 \rightarrow [Ag(NH_3)_2]^+](https://media.studieportalen.dk/images/equations/CDQWsoSvbh9xJd29IfrONQ==.gif)
Reaktionen er en kompleksdannelse.
Svar #5
06. april 2015 af ghdfir (Slettet)
Ok. Så hvis jeg skriver min dannelseskonstant og opløselighedsproduktet op så kan jeg godt se, at jeg skal gange de to for at få ligevægtskonstanten.
Mht. den sidste opgave, hvor jeg skal beregne massen af sølv(I)iodat, som kan opløses i 100,0 ml 2,00 M NH3. Jeg har gjort følgende. Jeg beregner stofmængden af NH3 n=C*V n=2*0.1=0,2 mol. Da forholdet er 1:2 må stofmængden af sølv(I)iodat være 0,1 mol. Jeg beregner massen med formlen m=n*M n=0,1 mol*282,8 g/mol= 28,28 g. Er det rigtigt?
Svar #6
07. april 2015 af Heptan
Nej, du skal lave en ligevægtsberegning med ligevægten fra 5b). Antagelsen bygger på at al sølv findes i komplekset, og at der er uendeligt lidt som ikke er i et kompleks. [IO3-] kan passende angives ved x i ligevægt, og det udnyttes at [Ag(NH3)2]+ = [IO3-] = x. Ammoniakkoncentrationen ændrer sig så med 2x.
Heraf fås, i ligevægt:
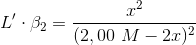
Ligningen løses mht. x, som også er lig med koncentrationen af sølv ... så kan man let beregne stofmængden og dermed massen af sølv(I)iodat der blev opløst.
Jeg får m(AgIO3) = 16,74 g
Skriv et svar til: opløselighed
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


