Kemi
aktuelle koncentration
Hej jeg har svært ved at løse disse opgaver, jeg håber i vil hjælpe
pH for en 0,0100 M vandig opløsning af butansyre er lig 3,40 ved 25 0C.
a) Beregn den aktuelle koncentration af H3O+ i denne opløsning.
b) Beregn den aktuelle koncentration af ikke-hydronolyseret butansyre i opløsningen.
c) Beregn ud fra de givne oplysninger pKs for smørsyre ved 25 0C.
tak på forhånd
Svar #1
10. april 2015 af Heptan
a)
![[H_3O^+]=10^{-pH}\ \textup{M}](https://media.studieportalen.dk/images/equations/NV-PqHzyR5OcqW70MuJgWg==.gif)
b)
Da pH = 3,40 << 7 er det rimeligt at se bort fra vands egendissociation, og hermed fås
![[CH_3(CH_2)_2CO_2H]=0,0100\ \textup{M}-[H_3O^+]](https://media.studieportalen.dk/images/equations/X7xGHqtN289N4F_eeW3QLA==.gif)
med antagelsen
![[CH_3(CH_2)_2CO_2^-]=[H_3O^+]](https://media.studieportalen.dk/images/equations/qdEdyh0V0gUYgu1--_XI_Q==.gif)
c)
Beregn først syrestyrkekonstanten Ks:
![K_S=\frac{[CH_3(CH_2)_2CO_2^-]\cdot [H_3O^+]}{[CH_3(CH_2)_2CO_2H]}](https://media.studieportalen.dk/images/equations/5X5DYqr9ecPFyrEPJlPCqw==.gif)
Heraf
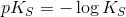
Svar #2
16. april 2015 af spassernumber12 (Slettet)
kan jeg få lidt mere hjælp til b'eren
så jeg siger
[butansyre]= 0.0100 M - 3.981 M passer det?
Skriv et svar til: aktuelle koncentration
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





![c_s=[CH_3(CH_2)_2CO_2H]+[CH_3(CH_2)_2CO_2^-]](https://media.studieportalen.dk/images/equations/TDy9k78ddGR3JlLdU-B0Sw==.gif)