Kemi
Syre-base ligevægte
Har lige et par opgver der driller "lidt" og jeg kan ikke helt fange fidusen i dem.
Det er syre-base ligevægte og jeg forstår fint det grundlæggende princip men kan ikke helt fange metoden så jeg kan få dem regnet. Håber I har tid til at hjælpe, så jeg kan få afleveret.
1. Muskler syrer nogle gange til fx ved en sportspræstation Det skyldes en ophobning af mælkesyre. I en vandig opløsning på 1,00 mol/L mælkesyre er 2,94% af syren omdannet til korresponderende base laktationen.
Udregn syrestyrkekonstanten for denne syre
2. Salmiak lakrids indeholder ammoniumchlorid. Ammoniumchlorid reagerer surt, når lakrids opløses i mundens spyt. Vi antager at den formelle koncentration, c, er af ammonium i mundhulen er 1,00 mol/L
Opskriv reaktionsskeamet (har jeg gjort) og beregn pH og [H3O+].
Beregn ioniseringsgraden og kommenter den i forhold til spyts pH.
3. Smørsyres kemiske navn er butansyre. Smørsyren har en meget ubehagelig lugt.I en fortyndet opløsning af butansyre måles pH til 3,4. Syrestyrkekonstanten 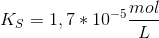 .
.
Beregn den aktuelle koncentration af butansyre.
Opgaverne er lidt sammem princip. Og der er flere af dem, men jeg kan ikke helt fange metoden. Håber en venlig sjæl vil guide mig på vej så jeg kan få afleveret til min faglærer (er fjernstuderende).
Svar #4
30. december 2015 af Light-Lover (Slettet)
Mathon:
Tak. Det er virkelig en stor hjælp. Føler mig helt dum. Især fordi jeg har haft tingene på et meget højere niveau engang.
Skriv et svar til: Syre-base ligevægte
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





![k_s=\frac{\left [ H_3O^+ \right ]^2}{c_s-\left [ H_3O^+ \right ]}](https://media.studieportalen.dk/images/equations/tzhfJnchtzkPjWeGzQKDnw==.gif)
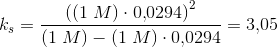
![\frac{\left [ H_3O^+ \right ]^2}{c_s-\left [ H_3O^+ \right ]}=10^{-pK_s}\; M\; \; \; \; \; 0<\left [ H_3O^+ \right ]<c_s](https://media.studieportalen.dk/images/equations/K-8lMPdTZ5FFC4MrpDusKw==.gif)
![\frac{\left [ H_3O^+ \right ]^2}{(1\; M)-\left [ H_3O^+ \right ]}=10^{-9{,}25}\; M](https://media.studieportalen.dk/images/equations/1-jNeCp4secPB5HLRZt0AA==.gif)
![\left [ H_3O^+ \right ]=2{,}37126\cdot 10^{-5}\; M](https://media.studieportalen.dk/images/equations/I_m1WU102kTo7p2fsHjuZw==.gif)
![pH=-\log\left (\left [ H_3O^+ \right ] /M \right )=-\log\left (2{,}37126\cdot 10^{-5}\right)=4{,}63](https://media.studieportalen.dk/images/equations/V7YRzcfI8ikPIEMfM4B9gA==.gif)
![\frac{ \left [ H_3O^+ \right ] ^2}{\left [ C_3H_7COOH \right ]}=K_s](https://media.studieportalen.dk/images/equations/ZcXv9reEQdPJ2A4dGnXF1g==.gif)
![\left [ C_3H_7COOH \right ]=\frac{ \left [ H_3O^+ \right ] ^2}{K_s}](https://media.studieportalen.dk/images/equations/AF3gsG1iTcCiEJssxVHPlA==.gif)
![\left [ C_3H_7COOH \right ]=\frac{ 10^{-2p\! H}\; M^2}{K_s}](https://media.studieportalen.dk/images/equations/tQGvd3tTCJSW3VL8gLw_3A==.gif)
![\left [ C_3H_7COOH \right ]=\frac{ 10^{-6{,}8}\; M^2}{1{,}7\cdot 10^{-5}\; M}=9{,}322\cdot 10^{-3}\; M](https://media.studieportalen.dk/images/equations/nFQ1yzAcNVOPy7wGVfXHCg==.gif)