Kemi
Forberedelse til eksamen i morgen
Hej Studieportalen
Jeg står og skal til eksamen i morgen, og har tidligere på året haft en prøve i et tidligere eksamensæt.
Jeg har fået resultatet af prøven og nu har jeg forsøgt at rette nogle af de tidligere fejl jeg havde, men føler stadigvæk der er et par ting jeg mangler. Det kunne være super rart, hvis der var en venlig sjæl, som ville hjælpe med at udpege nogle ting jeg skal udrede :-)
På forhånd tak for hjælpen og god sommer :-)!
Jeg har forneden vedhæftet i ZIP-filen et udklip af eksamensættet og min besvarelse :)
Svar #2
01. juni 2016 af Radissen (Slettet)
Nej desværre ikke, ellers havde jeg ikke spurgt om hjælp :)
Svar #3
01. juni 2016 af Soeffi
#0. Opgave 2 omredigeret.
Svar #4
01. juni 2016 af Radissen (Slettet)
Jeg har allerede vedhæftet opgaverne, og min besvarelse, jeg ønsker blot at få bekræftet om de er korrekte eller forkerte :)
Svar #5
01. juni 2016 af Skaljeglavedinelektier
Opgave 2: Brezel
a) 0,1887 M
b) 11,79
c) Overholder (0,64 M)
Opgave 4: Cobaltforbindelser i ligevægt
a) Co2+ og to Cl-
b) 0,0044 M
c) 0,00349 M
d) ΔH = -50,28 kJ/mol og ΔS = -193,66 J/(mol*K)
e) ΔS passer fint da man går fra 4 til 2 molekyler. Absorbansen vil stige.
Svar #6
01. juni 2016 af Radissen (Slettet)
Hvordan er du kommet frem til koncentrationen i B) og C) ? Jeg får 0.0137M i b'eren og i c'eren der får jeg at koncentrationen skal være 0.0011M?
Svar #8
01. juni 2016 af Radissen (Slettet)
Først tager jeg de 12mL af stamopløsningen og udregner molarmassen
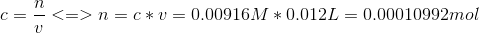
Herefter udregner jeg koncntrationen med det nye volumen
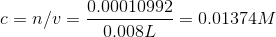
Dernæst opgave C hvor jeg skulle udregne koncentrationerne af B og R
Jeg får oplyst at absorbansen er 0.0331 og jeg har et givet funktionsudtryk, derfor gør jeg følgende: ![A=374.78M^{-1}*[B]-0.0083 <=> solve(0.0331=374.78m^{-1}*x-0.0083,x)=0.0001104648060M](https://media.studieportalen.dk/images/equations/e3B04v-gWXsnhCA72xHm8w==.gif)
Herfra antager jeg at koncentrationerne er ens da der er ligevægt. Men jeg havde dog en god fornemmelse da jeg løste opgaven at dette var forkert.
Svar #9
01. juni 2016 af Skaljeglavedinelektier
b) Jeg bruger formlen: cfør * Vfør = cefter * Vfør
c) Absorbansen er 0,331 og ikke 0,0331. Du trækker værdien for x fra koncentrationen, du finder i b).
Svar #10
01. juni 2016 af Radissen (Slettet)
b) det giver god mening nu, tak.
c) Så får vi en individuel koncentration for både B&R på 0.0035M? (tror ikke jeg er helt med)
Svar #11
01. juni 2016 af Skaljeglavedinelektier
Kig på reaktionen der sker. B og R reagerer i forholdet 1:1.
Der omdannes noget af B, som bliver til R. Dette må betyde, at startkoncentrationen af B minus slutkoncentrationen af B må være koncentrationen af R i ligevægtsblandingen. Startkoncentrationen af B finder du i b) og slutkoncentrationen af B finder du ved brug af absorbansen.
Skriv et svar til: Forberedelse til eksamen i morgen
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


