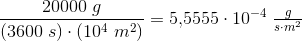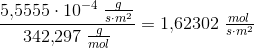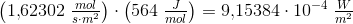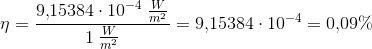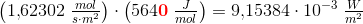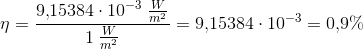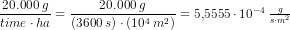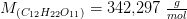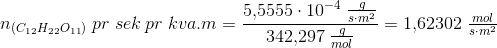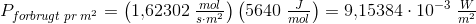Kemi
Termodynamik
Hej. Jeg skal besvare nedenstående spørgsmål og jeg har tænkt i lang tid nu, men kan simpelthen ikke se, hvordan jeg skal gribe det her an, er der en der kan hjælpe mig?
Solen udsender energi med en hastighed på 1 watt pr. kvadratmeter jordoverflade (1 watt = 1 J/s). Planterne på en mark producerer hvad der svarer til 20 kg sucrose (C12H22O11) pr. time pr. hektar. Under antagelse af, at sucrose produceres ved reaktionen:
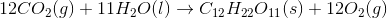
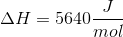
Beregn den brøkdel af sollyset, der foregår til at producere sucrose - dvs. effektiviteten af fotosyntesen.
Svar #3
13. september 2016 af Troels1993 (Slettet)
Nårh okay nu kan jeg forstå det. Men hvor er det første du skrev henne. Du skrev noget med energivinding pr...?
Skriv et svar til: Termodynamik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.