Kemi
Ækvialens MAHTOON
et spg. siger, at man kan bestemme den dominerende ionform på halvækvialens på grafen. Hvad er halækvialens punktet, og hvordan skal det aflæses?
Svar #1
01. juni 2022 af mathon
Ækvivalens er ved anvendt titratormængde Vo (mL).
Halvækvivalens er ved anvendt titratormængde 1/2·Vo (mL).
Svar #2
01. juni 2022 af yyyyyyyyyyyy
#1Ækvivalens er ved anvendt titratormængde Vo (mL).
Halvækvivalens er ved anvendt titratormængde 1/2·Vo (mL).
Så anvednt titrator mængde fidnes altid, der hvor den er stejlest, at lodret og halvækvialens er der hvor den er vandret?
Svar #5
02. juni 2022 af mathon
Du har jo
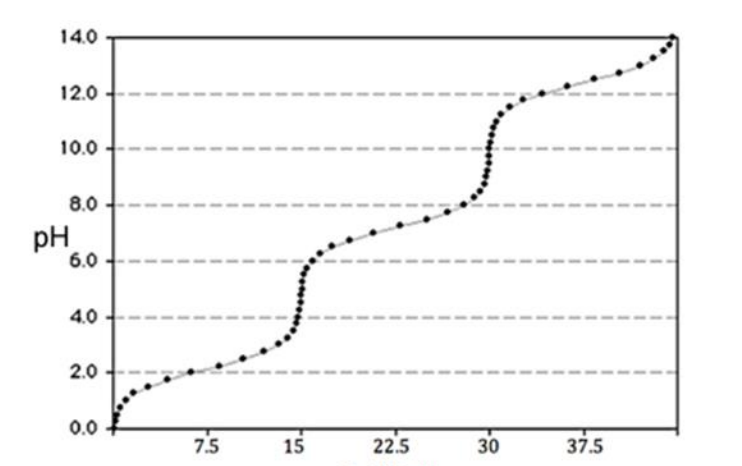
Med to ækvivalenspunkter.
Her kan du indtegne to skrå vendetangenter.
Svar #6
02. juni 2022 af yyyyyyyyyyyy
#5Du har jo
Med to ækvivalenspunkter.
Her kan du indtegne to skrå vendetangenter.
De bliver jo helt lodrette nærmest
Svar #8
02. juni 2022 af yyyyyyyyyyyy
#7Det gør de ikke

du kommer emd nogle formler jeg aldrig har set og som jeg dsv. ikke skal bruge. Kan du muligvis tegne vendetangenterne på skitsen?
Svar #10
02. juni 2022 af yyyyyyyyyyyy
#9Så skal du vel heller ikke bruge vendetangenterne.
nej, tlnker jeg heller ikke. Men forstår ikke hvordan de får ionfarmenre på hhv. 6, 8 og 10?? det giver bare ingen symmetri. når amn kigger på grafen
Skriv et svar til: Ækvialens MAHTOON
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

