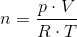Kemi
kemi B hjælp
er der nogen der kan hjælp mig med opgaveren nede unde ? mange tak på forhånd
En lodretstående cylinder indeholder tør atmosfærisk luft med temperaturen 23 °C.
Cylinderen er lukket for oven med et stempel, der kan bevæges friktionsfrit.
Massen af stemplet er afpasset, så trykket i cylinderen er 1,5 bar, og cylinderens volumen er 3,5 L ved temperaturen 23 °C.
a) Beregn gassens masse.
b) Beregn gassens densitet.
Svar #1
04. september 2014 af abuuzeyd (Slettet)
er der nogen de kan forklar mig dette opgave på en meget detaljerede måde mage tak
Svar #3
04. september 2014 af abuuzeyd (Slettet)
M(tør atm luft) = 28,81 g/mol
hvor finder du det hen?
Svar #4
04. september 2014 af mathon
Hvis vi ser bort fra små mængder argon
består tør atm. luft
N af 4 dele N2 og 1 del O2
Ud af 5 molekyler består de 4 af N2 dvs med massen 4 · (2 · 14,007) u = 112,056 u
Ud af 5 molekyler består 1 af O2 dvs med massen 1 · (2 · 15,999) u = 31,998 u
Den samlede masse af 5 molekyler er (112,056 + 31,998) u = 144,054 u
Gennemsnitsmolekylmassen er (144,054 u) / 5 = 28,81 u/molekyle = 28,81g/mol
Skriv et svar til: kemi B hjælp
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.