Kemi
Lightergas - idealgasligningen
Jeg skal ved hjælp af idealgasligningen bestemme, hvilke stoffer, lightergas er en blanding af.
Jeg har beregnet MLightergas til at være 45,83 g/mol. Følgende gasser er kandidatgasser:
CH4 (16,04 g/mol)
C2H6 (30,07 g/mol)
C3H8 (44,10 g/mol)
C4H10 (58,12 g/mol)
C5H12 (72,15 g/mol)
Umiddelbart ville jeg sige at lightergas bestod af propan, idet mine resultater ligger molarmassen nærmest. Jeg har efterfølgende søgt på studieportalen, og det lader til at resultatet bør angives i procentvis fordeling af to stoffer (sådan så den praktiske og teoretiske udregning underbygger hinanden, gætter jeg på). Hvordan bestemmer jeg det andet stof og hvilket stof lightergas består af?
Mvh Emma Møller :o)
Svar #1
15. november 2014 af OliverGlue
Det kan du ikke. Har du opgaveteksten?
Lightergas består ofte af butan eller en blanding af propan og butan.
Svar #2
15. november 2014 af ntrbd (Slettet)
Her er min klassekammerats indscannede forsøgsbeskrivelse. Spørgsmålet findes på side 2, spørgsmål 6. Det kan også være, jeg har misforstået opgaven? :)
Jeg kender bl.a. massen og volumen af lightergassen samt barometerafstanden mm.
Svar #3
15. november 2014 af OliverGlue
#2 Hm udregningerne ser korrekte ud. Jeg kan ikke komme på andet end. Du ved lightergas enten er butan eller en blanding af butan og methan, da molarmassen er højere end rent methan antages det, at der er butan i blandingen.
x*Mmethan+(1-x)*Mbutan=45.83g/mol hvor x er molbrøken, x=0.876, husk x_methan+x_butan=1
dv.s. blandingen indeholder 87.6% methan og 12.4% butan.
Svar #4
15. november 2014 af ntrbd (Slettet)
Hvorfra ved jeg dette?
"Hm udregningerne ser korrekte ud. Jeg kan ikke komme på andet end. Du ved lightergas enten er butan eller en blanding af butan og methan, "
Dine udregninger ligner meget dem, jeg er stødt på på studieportalen. Jeg kender ikke til formlen eller dens funktion? :-)
Svar #5
15. november 2014 af OliverGlue
#4 En antagelse du må gøre for at lave opgaven, ellers kan du altid lave en linær kombination af samtlige gasser, ej gunstigt. Det er blot empiri, det er kendt hvad en lighter indeholder af gas.
I udregningen finder du en molbrøk af methan og butan som giver en molarmassen på netop 45.83. Molbrøken for methan er blot 1, for butan vil den da være x_methan+x_butan=1 => x_butan=1-x_methan.
Svar #6
15. november 2014 af ntrbd (Slettet)
Jeg har ikke tilegnet mig empirien, og er meget glad for teori. :-)
Jeg vil undersøge emnet "molbrøker" yderligere, så jeg forstår dine udregninger.
Tak for hjælpen!
Svar #7
15. november 2014 af Heptan
Hmm nahh, man kan ikke ud fra de data bestemme hvilke gasser der er tale om... men da molarmassen er større end 44,10 g/mol må det betyde at der enten er butan eller pentan (eller begge), udover nogle af de lettere gasser. Hvis vi siger der er to forskelige gasser i blandingen, kan vi jo lave alle mulige kombinationer ... butan og propan ... pentan og propan ... butan og ethan ... osv osv
Lidt underligt molarmassen ikke er større, består lightergas ikke mest af butan? :-)
Svar #8
16. november 2014 af ntrbd (Slettet)
#7Hmm nahh, man kan ikke ud fra de data bestemme hvilke gasser der er tale om... men da molarmassen er større end 44,10 g/mol må det betyde at der enten er butan eller pentan (eller begge), udover nogle af de lettere gasser. Hvis vi siger der er to forskelige gasser i blandingen, kan vi jo lave alle mulige kombinationer ... butan og propan ... pentan og propan ... butan og ethan ... osv osv
Lidt underligt molarmassen ikke er større, består lightergas ikke mest af butan? :-)
Jeg ved det ikke - jeg har ikke selv lavet forsøget. :) Hvordan kan man opstille udregninger for kombinationerne?
#3#2 Hm udregningerne ser korrekte ud. Jeg kan ikke komme på andet end. Du ved lightergas enten er butan eller en blanding af butan og methan, da molarmassen er højere end rent methan antages det, at der er butan i blandingen.
x*Mmethan+(1-x)*Mbutan=45.83g/mol hvor x er molbrøken, x=0.876, husk x_methan+x_butan=1
dv.s. blandingen indeholder 87.6% methan og 12.4% butan.
Hvordan er du kommet frem til dine resultater vedr. molbrøken?
Svar #9
16. november 2014 af ntrbd (Slettet)
Fandt dette i et andet indlæg:
Molbrøk er defineret som antal mol af et givet stof divideret med antal mol i alt.
Kan jeg beregne procentfordelingen, hvis jeg kender stofmængden for lightergas (0,0096 mol)?
Svar #10
16. november 2014 af Heptan
Ja, hvis vi antager at lightergassen kun består af methan og butan, ligesom #3, så kan vi beregne procentfordelingen/molbrøken.
Du kan enten bruge stofmængden 0,0096 mol og massen 0,44 g, eller blot den molare masse 45,83 g/mol I har fundet. Som redegjort i #3 kan man altså opstille ligningen
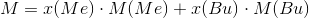
Der er to ubekendte her, så vi mangler en ligning mere. Det er den her:
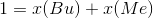
Så kan man løse de to ligninger med de to ubekendte. Jeg får til gengæld nogle andre resultater,
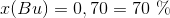
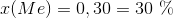
Man kan gøre det samme for alle de andre lightergaspar.
Skriv et svar til: Lightergas - idealgasligningen
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


