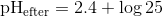Kemi
kendt pH
20 mL saltsyreopløsning (pH 2,4) fortyndes ad 500 mL med dem. vand.
Svar #1
07. januar 2015 af LeonhardEuler
Saltsyreopløsningen fortyndes 500+20/20 = 26 gange.
Du har at
pH = 2,4 + log(26) ≈ 3,82
Svar #2
07. januar 2015 af Solvejens
#1
Sådan tror jeg ikke, jeg nogensinde har set min lære regne det på. :S Findes der andre måder?
Svar #3
07. januar 2015 af LeonhardEuler
Benyt pH til at finde oxoniumkoncentrationen. Find nu oxoniumionstofmængden ved hjælp af oxoniumkoncentrationen og oplysningen 20 mL saltsyreopløsning. Find den nye oxoniumionkoncentration ved fortydning med 500 mL vand. Benyt den nye pH værdi.
Svar #4
07. januar 2015 af Solvejens
#1
Min lærer har sagt noget med:
Hvis pH kendes: pH = - log [ H+ ] => [ H+ ] = 10 -pH
Svar #5
07. januar 2015 af LeonhardEuler
Ja netop. Benyt den definition til at beregne oxoniumkoncentrationen.
Svar #7
07. januar 2015 af OliverGlue
#5 :
Næsten rigtigt, stofmængdekoncentrationen har enheden molær og ikke mol. Det må være din start koncentration, og ud fra fortydningsformel kan du indse at den fortyndes med en faktor 26, da
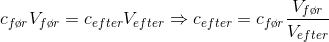
som netop siger koncentration efter en fortydning er lig med koncentration før fortydning ganget med brøken udregnet i #1. Du har fundet koncentration før fortyndning til 0.00398M og den fortyndes med en faktor 26, det giver
![c_{efter}=0.00398\mathrm{M}\cdot\dfrac{1}{26}=0.000153\Rightarrow\mathrm{pH=-log[H_{3}O^{+}]\Rightarrow pH=-log(0.000153)=3.82}](https://media.studieportalen.dk/images/equations/NsOkRLtktGcz03N0BEFIJA==.gif)
#1 Udledning af udtrykket :
![\mathrm{pH_{f\o r}=-\log[H_{3}O^{+}]}](https://media.studieportalen.dk/images/equations/yIbvzTDDOqOdApwEpM8vaA==.gif)
Koncentrationen af hydronium fortyndes med en faktor 26 forklaret i #1, det giver
![\mathrm{pH_{efter}=-\log\dfrac{[H_{3}O^{+}]}{26}}](https://media.studieportalen.dk/images/equations/B95XTpO1o1KKfKaeK2--Kg==.gif)
som kan omskrives ud fra logaritmeregneregler
![\mathrm{pH_{efter}=-\log\dfrac{[H_{3}O^{+}]}{26}}=-(\log\mathrm{[H_{3}O^{+}]-log26)=-\log[H_{3}O]^{+}}+\log26](https://media.studieportalen.dk/images/equations/hQFqWrV5xTVudkyGAkGqaA==.gif)
Hvor det første led netop er den oplyste pH
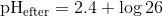
Skriv et svar til: kendt pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.