Kemi
Syre baser
Har fået udleveret et spørgsmål, som siger: Redegør for opdelingen af syrer i stærke, middelstærke, svage og meget svage syrer.
Hvad kan man redegør her?
Og efter det skriver han. Kom ind på syrestyrkekonstanten, Ks og på pKs.
Det samme her... Hjælp tak på forhånd.
Svar #1
31. maj 2015 af mathon
Syrestyrke fik du forklaret i
https://www.studieportalen.dk/forums/thread.aspx?id=1608305
Svar #2
31. maj 2015 af mathon
Når for ioniseringsgraden 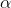 i demivand
i demivand 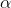 for en monohydron 1 M syre
for en monohydron 1 M syre
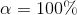 er syren stærk
er syren stærk
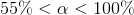 er syren middelstærk
er syren middelstærk
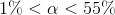 er syren svag
er syren svag
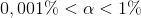 er syren meget svag
er syren meget svag
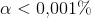 er syren yderst svag
er syren yderst svag
Svar #3
31. maj 2015 af mathon
mere præcist:
.
Når 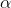 for en monohydron syre
for en monohydron syre
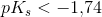 er syren stærk
er syren stærk
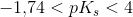 er syren middelstærk
er syren middelstærk
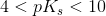 er syren svag
er syren svag
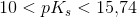 er syren meget svag
er syren meget svag
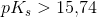 er syren yderst svag
er syren yderst svag
Svar #4
31. maj 2015 af UchihaItachi
Vi har ikke haft om ioniseringsgrad.. Kan man redegøre det på en anden måde...
Svar #6
01. juni 2015 af Heptan
En syre er stærk hvis den er stærkere end H3O+, forkortet H+. Lad os beregne hvor stærk "H+" er, ved at betragte rent vand med pH = 7:
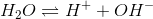
Opstiller vi ligevægtsloven har vi:
![K_v=\frac{[H^+][OH^-]}{[H_2O]}](https://media.studieportalen.dk/images/equations/EUTgTAv0ZPRhKNvBJ_f3bQ==.gif)
Man kan vise at [H+][OH-] = 10-14 M2 og [H2O] = 55,5 M ... heraf fås
![pK_v=-\log \left ( \frac{[H^+][OH^-]}{[H_2O]} \ \textup{M}^{-1}\right )=\mathbf{15,74}](https://media.studieportalen.dk/images/equations/94ejbea7Fhw_ry-gEsH42w==.gif)
Man kan måle eksperimentelt at pKa + pKb = 14 ved 25 ºC, og heraf fås
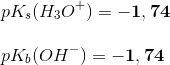
Skriv et svar til: Syre baser
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


