Kemi
bindende orbitaler
Hvordan ville I udregne den ?
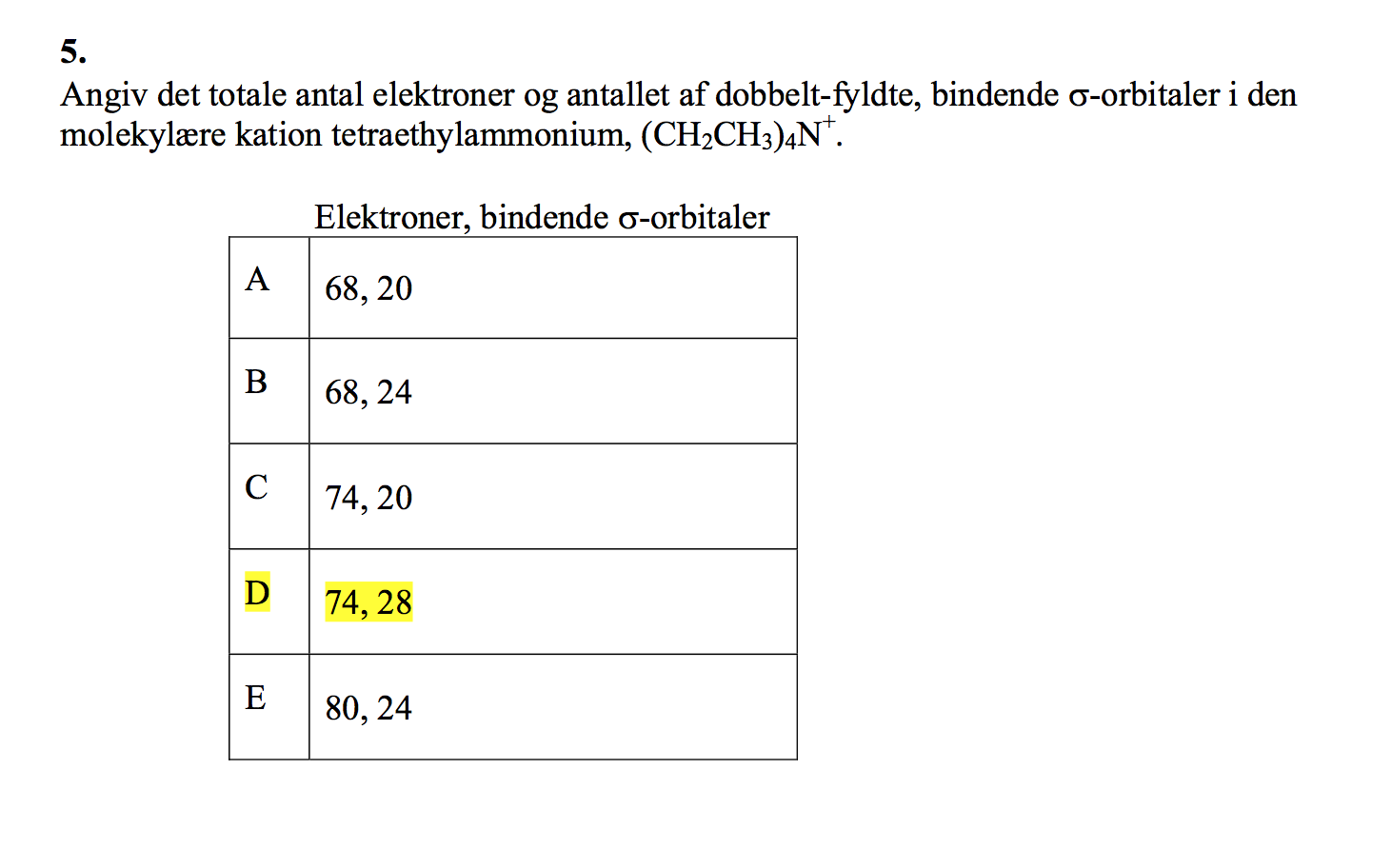
Jeg har svært ved det med orbitaler
Svar #1
09. december 2015 af Toonwire
Hejsa!
Lad os starte med at kigge på det totale antal elektroner i molekylet:
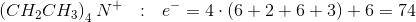
Så har vi da ihvertfald udelukket svarmulighederne A,B og E :)
Så langt så godt.
Orbitalerne kan være lidt sværere, men det behøver de ikke at være.

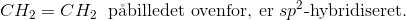
En god huskeregl er:
Ethvert atom kan kun lave præcis én sigma-binding med et andet atom.
? Alle bindinger derudover, til samme atom, er pi-bindinger.
Dvs. tegn Lewis strukturen for molekylet og tæl antal enkeltbindinger = antal sigma-bindinger:

Hvis du har talt korrekt (husk bindingerne fra C-H, de er ikke tegnet explicit her), så skulle du gerne få 28:
Svar #3
09. december 2015 af Searchmath
Gælder der det samme her?
Jeg tænker umiddelbart der må være en formel eller lignende man kan tage udgangspunkt i, men hver gang jeg har spurgt nogen omkring det har de selv været usikre.

Svar #4
09. december 2015 af Toonwire
\\\#\text{C-H}_3 = 4\\
3~\sigma\text{-bindinger for hvert C-H}_3 \text{ molekyle} = 4\cdot 3 ~\sigma \text{-bindinger}=12\\\\
\#\text{C-H}_2 = 4\\
2~\sigma\text{-bindinger for hvert C-H}_2 \text{ molekyle} = 4\cdot 2 ~\sigma \text{-bindinger}=8\\\\
\#\text{C-C} = 4\\
1~\sigma\text{-bindinger for hver C-C} \text{ binding} = 4\cdot 1 ~\sigma \text{-bindinger}=4\\\\
\#\text{C-N} = 4\\
1~\sigma\text{-bindinger for hvert C-N} \text{ binding} = 4\cdot 1 ~\sigma \text{-bindinger}=4\\\\
Svar #5
09. december 2015 af Toonwire
Ignorer #4, siden kan ikke compile LaTeX-koden af en eller anden årsag.
Angående bindingsordnen (forfærdelige billedskaleringer i øvrigt xD).
Det er ikke det samme princip der gør sig gældende som før.
For at bestemme bindingsordnen kan du ganske rigtigt bruge en formel der lyder:
BO=1/2 * (#bindende elektroner - #anti-bindende elektroner) - Beklager formatet, LaTeX driller...
Det kan godt blive lidt komplekst når vi når til den sidste af de tre bindinger, idet du har med en resonanshybrid at gøre. Så bliver du nødt til at tage gennemsnittet af hver af bindingsordnerne.
En super god regl jeg personligt bruger, og som sparer tid specielt i eksamenssituationer er følgende:
BO = antal bindinger / antal atomer bundet til det centrale atom.
Svar #6
09. december 2015 af Searchmath
Svar #7
09. december 2015 af Toonwire
#6
Du skal have fat i orbitalerne (den havde du nok regnet ud) og så tegne selve bindingen mellem de to atomer.
Lad mig tage et eksempel med bindende og antibindende for frit C-O.
C har 6 elektroner dvs. elektronkonfigurationen er 1s22s22p2
O har 8 elektroner dvs. elektronkonfigurationen er 1s22s22p4
Her koncentrerer vi os kun om valensorbitalen, 2p-orbitalen.
Carbon har 2 elektroner i sin 2p orbital, mens Oxygen har 4 elektroner i sin 2p orbital.
Jeg har prøvet at tegne det nedenfor, hvor  - og
- og 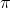 -bindingerne er de respektive bindende orbitaler.
-bindingerne er de respektive bindende orbitaler.
Derimod er 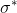 - og
- og 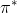 -bindingerne de anti-bindende orbitaler.
-bindingerne de anti-bindende orbitaler.
Udfyld elektronerne efter Aufbau princippet.

Som du kan se fyldes de i alt 6 elektroner kun i de bindende orbitaler, og altså ingen i de anti-bindindende. Dermed er bindingsordnen givet ved:
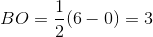
Svar #8
09. december 2015 af Toonwire
Tager vi samme eksempel, men nu bruger jeg den "hurtige" måde:
BO = antal bindinger / antal atomer bundet til det centrale atom.
Lewis struktur for carbon monooxid:
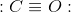
Antal bindinger = 3
Antal atomer bundet til Carbon = 1
BO = 3/1 = 3
Svar #9
09. december 2015 af Searchmath
Svar #10
09. december 2015 af Toonwire
#9
Jeg ved faktisk ikke om der ligger et formelt bevis bag den hurtige metode, men jeg har endnu ikke oplevet en bindingsorden den ikke har kunnet klare ;)
Svar #11
09. december 2015 af Searchmath
OB= antal bindinger/ antal bindinger til centreret grundstof ? Eller synes du det er bedre man lærer Aufbau princippet? Kan det lade sig gøre at lære den allerede i dag?
Svar #12
09. december 2015 af Toonwire
Aufbau princippet er bare hvordan man fylder orbitalerne ud. Først alle spin op én gang, så alle spin ned bagefter. Det kan du vel sagtens lære ? :)
Svar #13
09. december 2015 af Searchmath
Har du en skabelon? :)
Svar #14
09. december 2015 af Toonwire
p-orbital eksempel:

Når du har fyldt orbitalen helt ud, videre til den næste orbital.
Start altid med at udfylde den laveste energitilstandsorbital og fortsæt så til næstlaveste osv.
Svar #15
09. december 2015 af Searchmath
Skriv et svar til: bindende orbitaler
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






