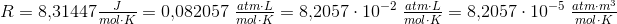Kemi
Hjælp til kemi!
Hej,
Jeg har virkelig brug for hjælp i den vedhæftede fil med opgave 4 (den med mandlerne) og opgave 5 (den med lastenbilen og gasflaskerne)
Håber virkelig i vil hjælpe
Tak på forhånd!
Svar #1
03. april 2016 af GalVidenskabsmand (Slettet)
Den dødelige dosis for manden er
6,7mg/kg * 92kg = 616,4 mg
HCN-indhold pr. mandel:
0,2mmol/mandel * 27,0253g/mol = 5,41 mg/mandel
Så han skal altså spise:
616,4mg / 5,41mg/mandel = 114 mandler for at dø.
Der står at posen var halvtom, så han har nok ikke spist 114.
Svar #2
03. april 2016 af calliemoore (Slettet)
Åh tusind tak! Vil du ikke også hjælpe mig med den anden opgave? :)
Svar #3
03. april 2016 af calliemoore (Slettet)
Jeg har virkelig også brug for hjælp til den anden opgave :((
Svar #4
03. april 2016 af GalVidenskabsmand (Slettet)
Hvis vi siger at det indvendige rumfang af førerhuset er ca. 5m3, så er stofmængden af luftmolekyler
pV=nRT <=>
n = pV/(RT)
n = 1 atm * 5m3 / (8,206*10-5 m3*atm/(K*mol) * 293K) = 210 mol
Så står der på den gule fareseddel at ved 0,05% dichlor, så dør man efter få minutter.
0,0005 * 210 mol = 0,104 mol
Der må altså højst være 0,104 mol dichlor i førerhuset.
1 flaske indeholder
n = 100bar * 20L /(0,08314472bar*L/(K*mol) * 293K) = 82 mol
Der skal altså kun ca. 1/800 af 1 flaskes indhold til at slå ham ihjel hvis det kommer ind i førerhuset. Men nu ligger de flasker vel heller ikke i førerhuset men omme bag i lastrummet? Jeg ved ikke lige hvorfor de flasker er under mistanke, men det vigtigste med opgaven er vel at vise noget kemi.
Svar #5
04. april 2016 af calliemoore (Slettet)
Men jeg forstår ikke hvor du har fået tallene
8,206*10-5
293K
(0,08314472bar*L/(K*mol)
fra?
Svar #6
04. april 2016 af calliemoore (Slettet)
Men jeg forstår ikke hvor du har fået tallene
8,206*10-5
293K
(0,08314472bar*L/(K*mol)
fra?
Svar #10
04. april 2016 af calliemoore (Slettet)
Okay jeg skal altså lige have hjælp med det her, jeg forstår det overhovedet ikke.
Svar #12
04. april 2016 af calliemoore (Slettet)
Ja men hvad er det så jeg finder ud af når jeg har beregnet dette?
Svar #13
04. april 2016 af GalVidenskabsmand (Slettet)
Du finder ud af hvor mange mol luftmolekyler der er i førerhuset.
Skriv et svar til: Hjælp til kemi!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.