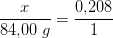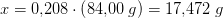Kemi
Natron og lagereddike...
Hej.
Sidder fast - mangler en forklaring på hvordan jeg behandler denne opgave, for de resultater jeg får synes ikke at være rigtige.
Du skal pynte et festlokale med 100 luftballoner, som hver er på 5 liter!!! Så meget luft kan du ikke puste? Men du kan fylde ballonerne med CO2, som du vil fremstille ved en reaktion mellem ”Natron” og lagereddike, disse findes på hylderne i alle supermarkeder. Før du tager på indkøb, skal du beregne, hvor meget ”Natron” og lagereddike du har brug for?
NaHCO3 + CH3COOH -> CO2 H2O + CH3COONa
Er det korrekt hvis jeg vil lave en beregningstabel, da jeg kender m for CO2 som er 500l - men hvordan hvis det skal være i g, eller må det godt være i ml? Og M somer 44,01 g/mol ?
Eller er det de helt forkerte formler jeg anvender?
Og i forhold til at finde volumen for Lagereddiken, hvordan gør jeg?
Mange tak på forhånd
Svar #3
16. januar 2014 af mathon
NaHCO3 + CH3COOH ---> CO2 + H2O + CH3COONa
ækvivalente mængder 84,00 g 60,05 g 1 mol
ved 20°C og 1 atm
fylder 1 mol CO2
(1 mol) • (0,082058 atm·L/(mol·K)) • (293 K)
V = ------------------------------------------------------------ = 24,04 L
1 atm
antal mol CO2 i 5 L
n = (5 L) / (24,04 L/mol) = 0,208 mol
hvoraf
NaHCO3 + CH3COOH ---> CO2 + H2O + CH3COONa
ækvivalente mængder 17,472 g 12,490 g 0,208 mol
lagereddikebehov: (12,490 g) / 0,05 = 249,8 g
5% lagereddike har densiteten ca 1,00 g/mL
249,8 g fylder derfor V = ( 249,8 g) / (1,00 g/mL) = 249,8 mL ≈ 1/4 L
.
Der skal bruges 17,5 g Natron og 1/4 L lagereddike.
Svar #4
16. januar 2014 af 19932014 (Slettet)
Tak - når man er rusten i kemi, så det tit nemmere at se resultatet og så forstå opgaven (;
Svar #5
18. januar 2014 af nullamatzen (Slettet)
Hvad er grunden til at der divideres med 0,05 ved lagereddikebehovet?
Svar #7
20. januar 2014 af 19932014 (Slettet)
Hvordan argumenterer jeg for at 5% lagereddike har en densitet på ca 1 g/ml (altså beregningen)
p= m/V = men jeg kender jo ikke dets volumien?
Hvordan kan det være man vælger at dele med 5L i forhold til 1 mol CO2 ? - ved godt det er indhold pr. ballon, men det totale antal L gas er 500 L CO2 som man skal finde.
Og det totale svar: Natron 17, 5 g og 0,25 L lagereddike, er det til 5L, eller alle 500L ?
Kan sagtens se tallenes sammenhæng, mangler bare lidt forklaringer på hvorfor? man gør som man gør.
Svar #8
20. januar 2014 af SuneChr
At fylde en ballon med en gasart kræver et tryk. Hvordan vil I få ballonerne fyldt i praksis?
Svar #9
20. januar 2014 af mathon
Der skal bruges 17,5 g Natron og 1/4 L lagereddike pr 5 L CO2.
dvs
der skal bruges 1,75 kg Natron og 25 L lagereddike pr 500 L CO2.
I #3's linje 13
haves 12,490 g ren eddikesyre. Lagereddiken indeholder kun 5 masse% eddikesyre, hvorfor der af
lagereddiken behøves
m(lagereddike) = (12,490 g) / 0,05 = 249,8 g
Svar #10
05. februar 2014 af Rotty (Slettet)
Skriv et svar til: Natron og lagereddike...
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.