Fysik
Hvad er forskellen på varmekapacitet og specifik varmekapacitet?
Ja: Hvad er forskellen på varmekapacitet og specifik varmekapacitet? og hvorfor kan jeg ikke slå varmekapacitet op i min databog når jeg kan læse om den i min formelsamling?
Svar #1
04. maj 2010 af larsen1111 (Slettet)
varme kapacitet er hvad en given genstand skal modtage af energi eller afgive for hhv. at stige eller falde præcis 1 K eller 1 C , dvs at alle forskellige genstande afhængig af størrelse og materiale har en varmekapacitet. Specifik varmekapacitet er til at finde i en tabel da den fortæller noget om hvor meget energi 1 kg af et materiale skal afgive eller modtage for hhv at stige eller falde 1K eller 1C. endvidere kan man sige at der er tale om termisk energi da det jo er varmeenergi eller arbejdsenergi der er tale om.
Svar #2
04. maj 2010 af 74 (Slettet)
Så når det bare er vand fra vandhanen jeg skal regne med så er C og c (ikke specifik og specifik) den samme eller skal jeg gange den specifikke med noget?
Svar #4
04. maj 2010 af 74 (Slettet)
En elektriske vandvarmer varmer vand. Den indeholder et varmelegme, som skal opvarme vand i det tempo det forbruges.
opgaven: Tildel passende fysiske størrelser til de relevante ting og vurder hvilken effekt vandvarmeren skal fungere ved.
Min besvarelse: Jeg har selv en lille husholdning. Samme tempo som det forbruges m betyde at hvis jeg i løbet af tre timer forbruger 5 liter vand som er 80 grader celcius varmt skal varmeren p tretimer opvarme det vand den tager ind, som nok er 15 grader op til 80 grader. Nyttevirkningen p vandvarmeren kunne jeg forestille mig er 85 %, men den fysiske størrelse har jo ikke nogen enhed. S den varmemængde Q, som skal bruges for at varme 5 liter vand som er 15 grader celcius op til 80 grader celcius, skal ikke kun tilføres! Faktisk skal der tilføres varmemængden 20/17*Q. Jf.: Q=U*0.85 -> U=20/17*q.
Så når jeg til formlen Q=C*ΔT og det er altså varmekapacitet der omtales i min formelsamling her, men jeg kan kun slå den specifikke op.
Svar #5
04. maj 2010 af Jerslev
#2: Varmekapacitet af et eller andet afhænger af, hvad det 'et eller andet' vejer. Det gør specifik varmekapacitet ikke.
mvh
Jerslev
Svar #7
04. maj 2010 af Jerslev
#6: Slå den specifikke varmekapacitet for vand op og gang med massen på vandet. Du vil sandsynligvis have formlen:
C = m*c
i din bog.
mvh
Jerslev
Svar #9
11. december 2019 af MadsNsdaM
Lige en kommentar til folk i fremtiden:
(Specifik Varmekapacitet VS Varmekapacitet)
Den specifikke varmekapacitet (c) fortæller hvor meget energi [Joule (J)] der skal til, for at varme et kilogram [kg] af stoffet op 1 grad [Kelvin (K)].
Enheden for den specifikke varmekapacitet (c) er altså:
Derfor kan man finde den mængde energi [Joule (J)], som skal til, for at varme stoffet op med f.eks. 20 grader.
Dette gør man ved at gange den specifikke varmekapacitet (c) med massen af stoffet (m) [kilogram (kg)] og den temperatur forskel/forøgelse (ΔT) [Kelvin (K)]
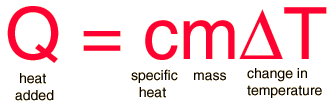
Den specifikke varmekapacitet (c) varierer lidt efter temperaturen, men generelt kan slås op på nettet og findes i bøger osv.
F.eks. er vands specifikke varmekapacitet:
og aluminium:
Når man har et legeme (objekt) der består af flere stoffer, som derfor har flere "specifikke varmekapaciteter" kan man finde ud af hvor meget energi der skal til for at varme hele legemet op.
Dette kan man gøre ved at bruge den samme formel og så addere (plusse) produkterne af de forskellige stoffers specifikke varmekapaciteter (c), masser (m) og temperatur forskel (ΔT) sammen.
Et eksempel kunne være energien der skal til for at varme en aluminiums gryde der vejer 1 kg med 2 liter vand i (2 kg) op med 20 grader.
Ved at bruge formlen kan det regnes ud ved at sige:
Eksempel med gryde
Det her kan godt gå hen og blive en lang smøre, når man har et legeme bestående af mange forskellige stoffer. Derfor giver man legemet dens egen værdi, nemlig dens Varmekapacitet (C).
Så kan man i stedet bruge denne formel:
(Læg mærke til at C-værdien har indraget de forskellige stoffers vægt, og derfor indgår massen ikke i den nye formel)
Varmekapaciteten fortæller hvor meget energi [Joule (J)] der skal til for at legemet (objektet) stiger 1 grad [Kelvin (K)].
Derfor har Varmekapaciteten enheden
Varme Kapaciteten findes ved at sige
Det kan ses at når man bruger formlen så ganger man temperaturen ind i alle parenteserne, og så kommer man tilbage til den gamle formel:
Skriv et svar til: Hvad er forskellen på varmekapacitet og specifik varmekapacitet?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


