Kemi
Opløsning og trykændring
Håber der er nogle søde sjæle derude, der kan hjælpe mig med følgende opgave:
En ny celle til et bombekalorimeter kalibreres med en 1,333 g benzoesyre (C6H5COOH, s) tablet, hvorved temperaturen stiger 1,353 K. Der fyldes 5,00 ml vand i bunden af cellen, som har et volumen på 2 dl. Ved forbrændingen tilsættes ilt med et tryk på 30 atm og begyndelsestemperaturen er 25,0 ºC.
Hvor meget af den tilsatte ilt opløses i vandet? Hvad er trykændringen fra dette inden forbrænding?
Svar #1
20. januar 2015 af Heptan
Henrys lov:
![K=\frac{p(O_{2\ (g)})}{[O_{2\ (aq)}]}](https://media.studieportalen.dk/images/equations/n56296zyj1LXPv4OdZzQXA==.gif)
Ligevægtskonstanten har jeg fundet til
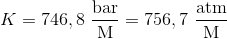 http://www.engineeringtoolbox.com/air-solubility-water-d_639.html
http://www.engineeringtoolbox.com/air-solubility-water-d_639.html
Svar #2
20. januar 2015 af LubDub
eller anskaf dig
CRC Handbook Of Chemistry And Physics
den såkaldte
gummibibel.
Den har stort set alt, hvad angår konstater og lignende
Svar #3
20. januar 2015 af Heptan
Jahh, men der står ikke svaret på opgaven. Jeg har problemer med at beregne koncentrations/trykændringen.
Svar #4
21. januar 2015 af Silahm
Har fået at vide, at svaret skal give:
b=0,038 mol/kg
og
p= 2,3 kPa
Men ved stadig ikke hvordan jeg skal finde frem til disse svar :-(
Svar #5
21. januar 2015 af Heptan
#4
Det giver mening. Hvis trykændringen er 0,023 bar, så er stofmængden som er opløst:
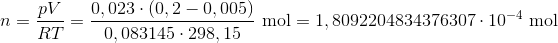
Det giver en molalitet på:
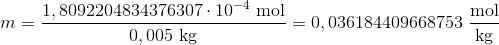
Det stemmer overens.
Svar #6
21. januar 2015 af Heptan
Jeg tror endelig jeg har den:
Antag at trykændringen er negligibel. Heraf fås
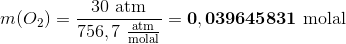
som tilsvarer stofmængden
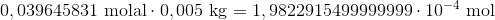
som tilsvarer trykændringen
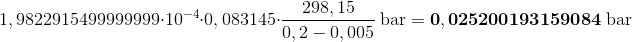
Antagelsen Δp << 30 atm er rimelig.
Den lille forskel skyldes nok at de har brugt en anden ligevægtskonstant (der er flere forskellige på nettet).
Skriv et svar til: Opløsning og trykændring
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





