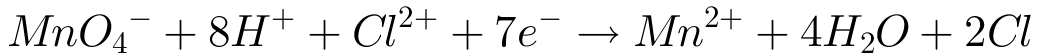Kemi
Redoxegenskaber for Mn
Godaften,
Jeg skal afstemme reaktionensskemaet for ![\left [ MnO_{4} \right ]^{-}](https://media.studieportalen.dk/images/equations/MnpldG7E8U2zuu1virnI8w==.gif) der reduceres til
der reduceres til  ionen med chlorid, jeg har prøvet sådan her:
ionen med chlorid, jeg har prøvet sådan her:
![\left [ MnO_4 \right ]^{-} +9H^{+} + Cl^{-} \rightarrow Mn^{2+} + 4H_{2}O + HCl](https://media.studieportalen.dk/images/equations/L4VbkCGWYdfhyFKJ6Ev-7g==.gif)
Derudover skal jeg opskrive standardreduktionspotentialerne over de mest oxiderede former og angive hvilken vej reaktionen forløber.. Det ved jeg ikke, hvordan man gør
Svar #1
01. november 2015 af Heptan
Reaktionen er en redoxreaktion. Husk, at der altid følger en oxidation med en reduktion. Dvs. chlorid bliver oxideret. Chlorid kan fx oxideres til dichlor.
Har du prøvet at slå stadardreduktionspotentialerne op? Reaktionen er spontan, hvis elektrodepotentialet er større end 0 V.
Skriv et svar til: Redoxegenskaber for Mn
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


![\left [ MnO_{4} \right ]^{-}+8H^{+} + Cl^{2+} +7e^{-}\rightarrow Mn^{2+}+4H_{2}O + 2Cl](https://media.studieportalen.dk/images/equations/DMut39RTqZeduHHCL4hu-Q==.gif)