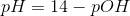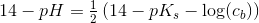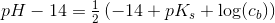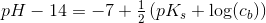Kemi
Beregn pH
Hej, nogen der kan hjælpe med opgave 1.d i den vedhæftede dokument.
I 1.c har jeg fået, at der skal tilsættes 18,9 mL KOH-opløsning for at nå ækvivalenspunktet.
Den næste opgave kan jeg ikke helt gennemskue.
Jeg tænker at man kan anvende formlen til at beregne pH for svage syrer i vand, men jeg får ikke det rigtige resultat.
Jeg beregner c: 0,005675 mol / (25 mL + 18,9 mL) / 1000 mL = 0,129271 M
pKs for butansyre er 4,82.
Nogen der kan hjælpe.
Svar #2
09. januar 2016 af Tina12453
Hvilket stof er C3H7COO- og hvorfor skal jeg beregne stofmængdekoncentrationen for dette stof?
Svar #3
10. januar 2016 af mathon
C3H7COO- er butanoationen.
Du skal først beregne ![[C_4H_7COO^-]](https://media.studieportalen.dk/images/equations/dU3wuKEFPz8SOSqeJoDcUQ==.gif) for efterfølgende at kunne beregne pH.
for efterfølgende at kunne beregne pH.
Svar #5
10. januar 2016 af Tina12453
Okay, tak. Men hvorfra ved jeg, at det er butanoationen, jeg skal finde stofmængdekoncentrationen på.
Jeg ved godt, at det er den korresponderende base til butansyre, men jeg kan ikke helt se, hvad der ligger bag dette.
Måske skal jeg lige have det skåret ud i pap.
Tak på forhånd.
Svar #8
10. januar 2016 af mathon
som er 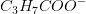 .
.
Dette er grunden til, at du skal beregnes koncentrationen af 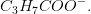
Svar #9
12. januar 2016 af Tina12453
Plejer formlen ikke se således ud for svage baser: pH=7+0.5(pKb+log(cb)
Hvorfor skal man anvende pks?
Skriv et svar til: Beregn pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



![c_b=[C_3H_7COO^-]](https://media.studieportalen.dk/images/equations/uCSLsgLyc8Tj--YuahpEnQ==.gif)

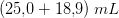 opløsning indeholdende
opløsning indeholdende 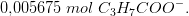
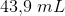 opløsning indeholdende
opløsning indeholdende ![c_b=[C_3H_7COO^-]=\frac{0{,}005675\; mol}{0{,}0439\; L}=0{,}1293\; M](https://media.studieportalen.dk/images/equations/r-LTy-ud_8Ns1UDqibcglg==.gif)
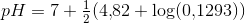
 til under titreringen?
til under titreringen?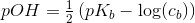 for svage baser.
for svage baser.