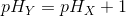Matematik
Brintion koncentrationen. HJÆLP!!!!
Hej, har virkelig brug for hjælp så hurtigt som muligt!
Der er givet dette spørgsmål: "I kemi har man begrebet pH - værdi til at beskrive om et stof er en syre eller en base. Hvis vi har at gøre med en syre, så kan vi abstrakt betegne den med symbolet HA, hvor A står for syreresten. Hvis man opløser syren i vand, opstår der en ligevægt, som kan udtrykkes ved: HA -> <- H+ + A-. For en stærk syre er ligevægten forskudt mod højre, for en svag syre er den forskudt mod venstre. Brintion - koncentrationen afgør, hvor stærk en syre, der er tale om. Helt præcis definerer man pH - værdien på følgende måde: pH= -log (H+). Hvor (H+) betegner brintion - koncentrationen målt i mol".
Jeg kan ikke finde ud af spørgsmål b og spørgsmål c som lyder følgende:
b) Som bekendt er den neutrale pH-værdi lig med 7, som fx i rent vand. Hvor stor er brintion - koncentrationen her?
c) I en syre X er brintion - koncentrationen (H+)x ti gange større en brintion -koncentrationen (H+)y for en syre Y. Hvor meget større er pH - værdien pHy for syren Y end pH - værdien pHx for syren X?
Hvis nogen kan hjælpe med det her så hurtigt som muligt ville det være dejligt!!!!
Skriv et svar til: Brintion koncentrationen. HJÆLP!!!!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




![pH=-\log\left ( \left [ H^+ \right ] \right )](https://media.studieportalen.dk/images/equations/w5ynev_xvuG4pC65b4zMVw==.gif)
![\left [ H^+ \right ]=10^{-pH}](https://media.studieportalen.dk/images/equations/PTUhnJmOMgr7cpkGBEjqJg==.gif)
![\left [ H^+ \right ]_X=10\cdot \left [ H^+ \right ]_Y](https://media.studieportalen.dk/images/equations/lcjeSPgT-CA6qVr0puPULQ==.gif)
![pH_Y=-\log\left ( \left [ H^+ \right ]_Y \right )](https://media.studieportalen.dk/images/equations/K4OBMN6P6RdA9-mfggm7qg==.gif)
![pH_X=-\log\left ( \left [ H^+ \right ]_Y\cdot 10 \right )=-\left ( \log\left ( \left [ H^+ \right ]_Y \right )+\log(10) \right )=pH_Y-1](https://media.studieportalen.dk/images/equations/mdN43Z-jG8rdzsFMpQgSFg==.gif)