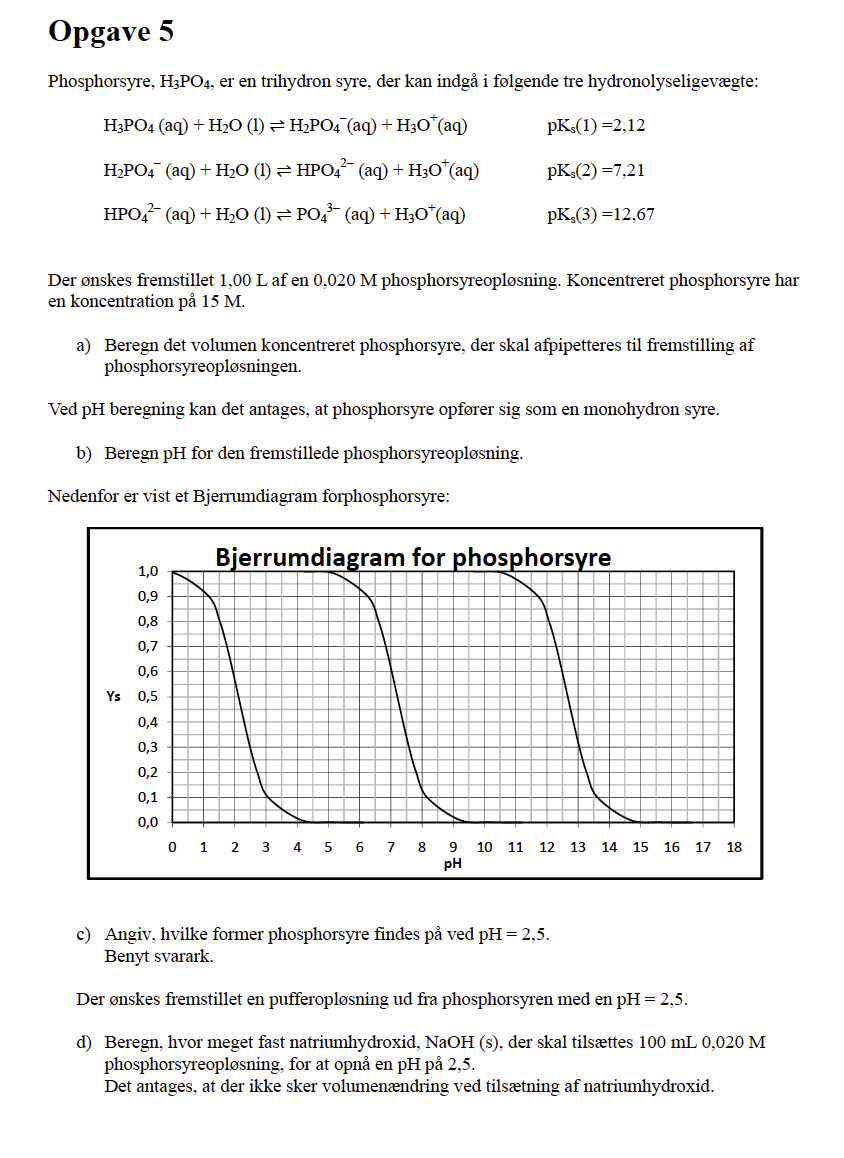
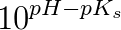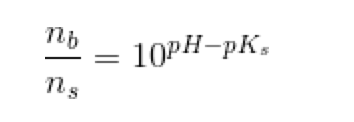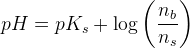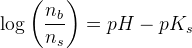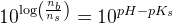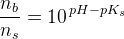Kemi
Pufferopløsning
Hej Studieportalen
Jeg er i gang med denne opgave – se vedhæft, men jeg ved ikke hvordan jeg skal løse opgave d. Jeg er gået helt i stå, så håber at der er nogle der kan hjælpe mig :)
Tak på forhånd.
Svar #2
24. marts 2016 af mathon
d)
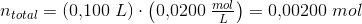
pufferligningen giver:
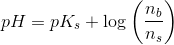 hvor
hvor 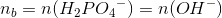
under forudsætning af, at phosphorsyren
optræder monohydront
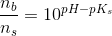
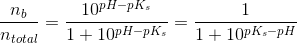
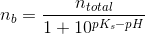
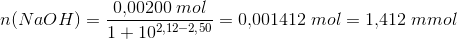
Svar #4
25. marts 2016 af lhp17
Jeg forstår ikke sammenhængen i denne ligning. (vedhæft)
Det står nemlig ikke i mine bøger.
Svar #8
25. marts 2016 af lhp17
Ok, så er jeg med, jeg havde ikke tænkt over at man isolere.
Hvorfor sættes 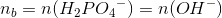 ?
?
Er det fordi de reagerer i forholdet 1:1?
Der sker følgende reaktion: H3PO4 + OH- -> H2PO4- + H2O
Skriv et svar til: Pufferopløsning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


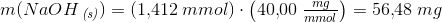
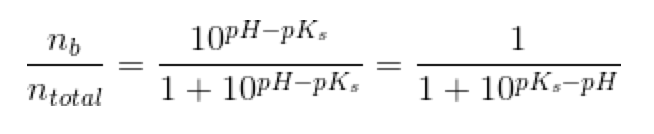 der forkortes med
der forkortes med