Kemi
Beregn pH af monohydrone baser
Hej derude! Er der en der kan hjælpe med denne opgave. jeg er helt lost..
På forhånd mange tak!
Beregn pH i følgende opløsninger af monohydrone baser:
Formlen man bruger til at beregne en basisk pH opløsningshed.
a) 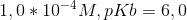
b) 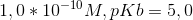
Svar #1
03. april 2016 af ChemistryIsKey
Der er i begge tilfælde tale om svage baser, da pKb > 4. Derfor kan du beregne pOH i de to opløsninger med formlen;
pOH = ½ * (pKb - log(cb))
Du har både koncentrationen og basestyrkeeksponenten for begge opløsninger og baser, så der er bare at sætte ind i formlen. Du bliver bedt om at beregne pH, og du kan derfor bruge sammenhængen mellem pOH og pH;
pH = 14 - pOH
:)
Svar #2
03. april 2016 af JaKoAndersen
Tak for din hjælp! Det fik jeg det også til.. Men mit facit siger noget andet
Svar #3
05. april 2016 af ChemistryIsKey
Okay - Formlen ovenfor er dog også en approksimation, der kun gælder for svage syrer. Hvis du vil være helt på den sikre side, kan du bruge formlen;
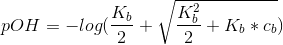
:)
Skriv et svar til: Beregn pH af monohydrone baser
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







