Kemi
Mængdeberegning - er jeg helt galt på den?
Man blander 10 g Cu med 50g Br2 og der sker følgende reaktion:
Cu+Br2 --> CuBr2
mCu = 10 g
MCu = 63,55 g/mol
n= 0,157
mBr2 = 50 g
MBr2= 159,81
Hvis jeg skal finde n: er det så korrekt, at stofferne reagerer i forholdet 1:1:1? Og derfor må nBr2 og være 0,157? eller betyder dibrom, at der må være dobbelt så stor en stofmængde for dibrom, og de derfor reagerer i forholder 1:2:1, så n= 2*0,157? ELLER er stofmængden for dibrom = 50 g / 159,81 g/mol = 0,31287153 mol? (hvis dette er tilfældet, hvis skal det så beregnes på denne måde? (undskyld de mange muligheder....)
Herefter skal jeg jo så finde m, M og n for CuBr2 .... Hvordan finder jeg n?
M CuBr2= 63,55 + 159,81 = 223,36
Herefter skal jeg finde den begrænsende faktor... Hvordan gør jeg dette?
Svar #1
02. august 2016 af Skaljeglavedinelektier
Stofmængden for Cu er rigtig nok 0,157 mol. Du skal dog huske ikke at runde af ved dine udregninger.
Stofmængden for Br2 skal du også finde. Den er ca. 0,313 mol.
Den begrænsende faktor må altså være kobber, fordi den først bliver brugt op ved reaktionen. Reaktionen forløber kun så længe, der er noget, der kan reagere.
Grundet at reaktionsforholdet mellem den begrænsende faktor, kobber, er 1:1 med kobber(II)bromid. Er stofmængden af kobber(II)bromid lig med stofmængden af kobber.
Du kender altså stofmængden af CuBr2 og molarmassen. Ud fra formlen 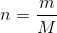 kan du så finde massen.
kan du så finde massen.
Svar #2
02. august 2016 af Manu0407 (Slettet)
Fedt!! Tusind tak for din hjælp.
m= 35,14602 g, right? :)
Svar #3
02. august 2016 af Manu0407 (Slettet)
ps. just to be sure: Når cu er den begrænsende faktor, og reaktionen derfor ikke kan forløbe videre herefter, er reaktionen så ufuldstændig, fordi der stadig er dibrom tilbage?
Svar #4
02. august 2016 af Skaljeglavedinelektier
Jo dit svar er rigtig - alt efter hvilke afrundinger du bruger.
Jeg ved ikke, om man gør brug af fuldstændig/ufuldstændig i den her sammenhæng. Man snakker normalt om det i forhold til forbrænding, men det gør sig sikkert også gældende i sammenhænge som denne.
Svar #5
02. august 2016 af Manu0407 (Slettet)
All right, mange tak!
Jeg har endnu et problem, håber du kan hjælp (undskyld besværligheden!!)
JEg har reaktionen 2 Fe2O3 + 3C --> 4 Fe + 3 Co2
jeg skal finde ud af, hvor mange g jern der dannes ud fra 200 g jernmalm.
jeg har fundet frem til følgende:
Jernmalm:
m= 200 g
M = 159,7 g/mol
n= 1,2523 mol
Da stofferne reagerer i forholder 2:3:4:3, må n for jern være :
2*1,2523 = 2,5046 mol
M = 4*55,86 = 223,4 g/mol
Men... når jeg så forsøger at finde m får jeg et helt sindssygt tal:
m= 223,4*2,5046 = 559,53764........ det kan da ikke passe? Men hvad gør jeg forkert?
Svar #6
02. august 2016 af Manu0407 (Slettet)
Nja... M = 55,85 g/mol... og m= 2,5046*55,85 = 139,88191 g.... Det passer vel bedre?
Svar #7
02. august 2016 af Skaljeglavedinelektier
Ja lige præcis. Du udregner molarmassen forkert - den er uafhængig af koefficienterne. Molarmassen af jern er desuden ca. 55,845 g/mol og ikke 55,86 g/mol.
Svar #8
02. august 2016 af Manu0407 (Slettet)
Okay :) (I min bog stor molarmassen desværre kun med 2 decimaler.) Men tak for hjælpen, det var venligt af dig!
Svar #9
02. august 2016 af Skaljeglavedinelektier
Det er det, studieportalen er til for :)
Det kan også være, det er tilstrækkeligt i nogle tilfælde, men 55,86 g/mol er stadig forkert afrundet i forhold til 55,845 g/mol.
I forhold til #3 kan det være, du tænker på ækvivalente mængder.
Svar #10
02. august 2016 af mathon
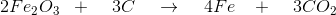
ækvivalente mængder: 2 mol 3 mol 4 mol 3 mol
2·159,691 g 3·12,011 g 4·55,847 g 3·132,027 g
319,382 g 36,033 g 223,388 g 132,027 g
aktuelle mængder: 200 g x
forholdsberegning:
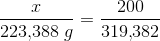
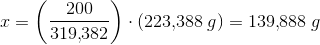
Under forudsætning af Carbon i overskud og optimal temperatur kan der af 200 g jernmalm dannes 139,888 g jern.
Svar #12
03. august 2016 af Manu0407 (Slettet)
Jeg kom til at tænke på noget ifht. den første opgave, hvor kobber er den begrænsende faktor........ Kan jeg beregne, hvor meget kobber i givet fald ville skulle have, for at have den ækvivalente mængde?
Svar #13
03. august 2016 af Skaljeglavedinelektier
Ja det kan du. I reaktionen skal stofmængden af de to være den samme, grundet reaktionsforholdet. Da du kender stofmængden af Br2 og molarmassen af Cu, kan du beregne massen af kobber, der skulle tilsættes for at opnå ækvivalente mængder.
Svar #14
03. august 2016 af Manu0407 (Slettet)
Så dvs. der skal ca. 19, 88 g Cu til, for at opnå ækvivalente mængder? :)
Skriv et svar til: Mængdeberegning - er jeg helt galt på den?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




