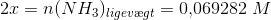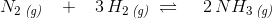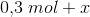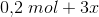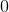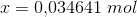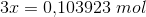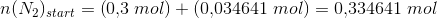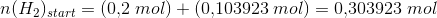Kemi
Opgave omkring kemisk ligevægt
Jeg har brug for hjælp til at løse en kemi-opgave, der omhandler ligevægt. Inden man kan besvare opgaven, kræver det resultatet fra tideligere opgave, som lyder:
Nitrogen og hydrogen bringes til at reagere i en beholder på 1 liter. Når ligevægten er opnået indeholder blandingen 0,30 mol nitrogen og 0,20 mol hydrogen. Beregn hvor mange mol ammoniak, der er i beholderen.
Ligevægtskonstant (Kc) = 2 M^-2
Svar: [NH3] = 0,069282 M
Herefter kommer opgaven jeg ikke kan løse, som lyder: Beregn hvor mange mol hydrogen og nitrogen, der blev ledt ind i beholderen fra start (inden ligevægten har indstillet sig).
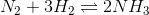
Hvordan finder jeg ud af det? Tak!
Skriv et svar til: Opgave omkring kemisk ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.