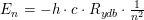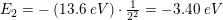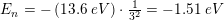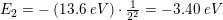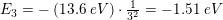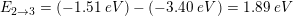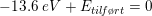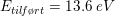Fysik
Excitaion og ionisering (hydrogenatom)
De første to dele af opgaven er løst, men jeg er i tivl om sidste del...
Hydrogenatomet er i grundtilstand. Jeg kender energien, der skal tilføres for at blive exciteret til tilstand nr. 2, 3, og 4:
Nr. 2: 10,2 eV
Nr. 3: 12,1 eV
Nr. 4: 12,75 eV
Beregn den energi, der skal tilføres for at excitere det yderligere til tilstand nr. 3:
12,1 eV - 10,2 eV = 1,9 eV
Sidste delopgave er jeg ikke med på:
Beregn ioniseringsenergien for et hydrogenatom i grundtilstanden, i tilstand nr. 2 og i tilstand nr. 3. Ioniseringsenergien er den energi, atomet skal tilføres for netop at frigøre en elektron.
Jeg skal vel bruge de 13,6 eV, men hvordan?
Svar #1
05. september 2017 af AngelOneOne
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #2
05. september 2017 af AngelOneOne
Hej,
Beregningen af ioniseringsenergien for H er givet ved:
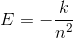
For hydrogen er k=13,6 eV og n er bindingsenergien i den bane (energiniveau), som elektronen er bundet.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #3
05. september 2017 af to1256
Hmm men det er stort set samme formel, som i første opgave.
Så hvis jeg siger fx udrenger skal nr 2:
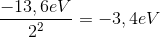
Er dette så facit for tilstanden i nr. 2?
Svar #7
07. september 2017 af to1256
jeg forstår ikke opgave c...
Hvornår frigives en elektron? hvordan udregnes dette
Skriv et svar til: Excitaion og ionisering (hydrogenatom)
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.