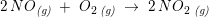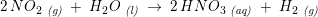Kemi
hjælp
Trin 1: NH3 (g) + O2 (g) → NO (g) + H2O (g) Afstem reaktionsskemaet og beregn hvor meget NO der dannes af 1 ton ammoniak. Derefter omdannes NO til nitrogendioxid ved endnu en forbrænding. Opskriv reaktionsskemaet og beregn hvor meget nitrogendioxid der kan fremstilles af den mængde NO der blev fremstillet i Trin 1 ?
Trin 2: →
Endelig reagere nitrogendioxid med vand og danner HNO3. Opskriv reaktionsskemaet og beregn hvor meget (ton) salpetersyre der kan fremstilles af 1 ton ammoniak ? Trin 3:
4NH3 (g) + 5O2 (g) → 4NO (g) + 6H2O (g)
men den der driller mig er
Derefter omdannes NO til nitrogendioxid ved endnu en forbrænding. Opskriv reaktionsskemaet og beregn hvor meget nitrogendioxid der kan fremstilles af den mængde NO der blev fremstillet i Trin 1 ?
Skriv et svar til: hjælp
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.