Kemi
Analyse opgaver
20. oktober 2018 af
tucogon
-
Niveau: Universitet/Videregående
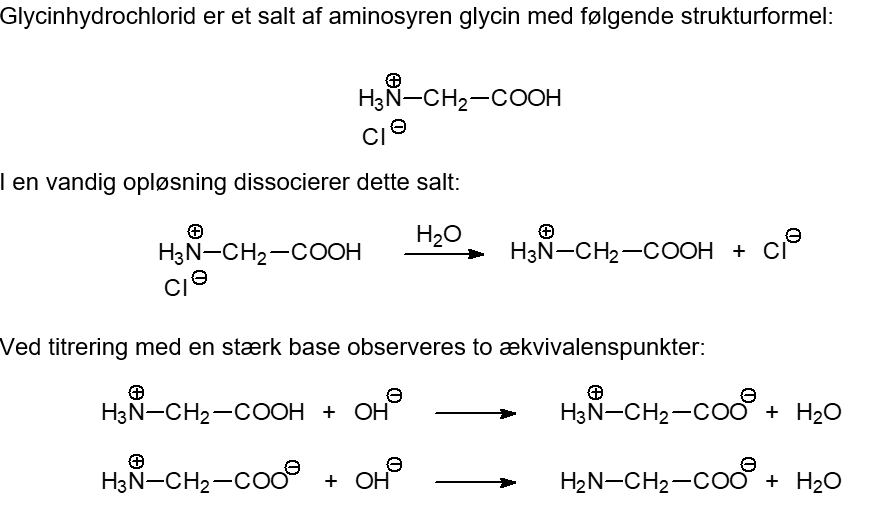
I en titreringsøvelse er der stillet følgende spm. (vedhæftet)
Hvordan laves de?
Vedhæftet fil: rap.PNG
Svar #2
20. oktober 2018 af tucogon
Ved 1. ækvivpunkt. er volumen af NaOH: 9.1mL
2. ækvivpunkt.: 19.1mL
Svar #9
21. oktober 2018 af mathon
pKs er pH-værdien lige efter tilsætning af halvt titratorvolumen.
Skriv et svar til: Analyse opgaver
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.