Fysik
Spektrallinje for hydrogen - energiniveaudiagram
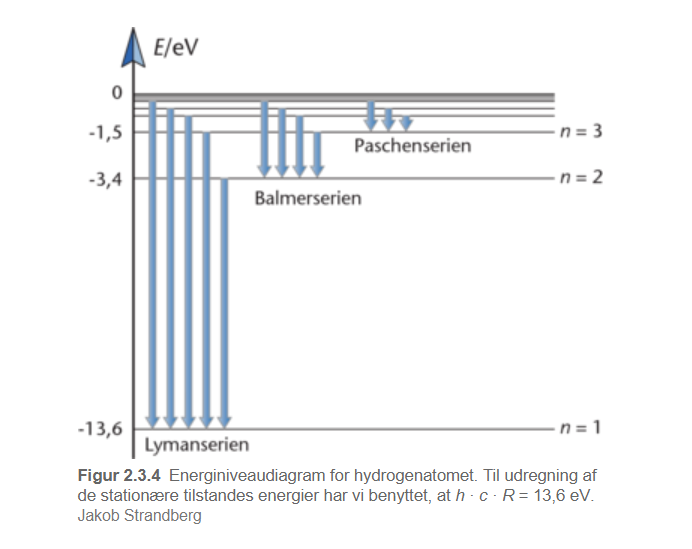
Jeg kigger på det her energiniveau diagram, som viser de overgange der danner hydrogens spektrallinjer. Hydrogens spektrallinje har 4 bølgelængder, men her ser jeg kun mulighed for 3?
Svar #2
14. december 2018 af mathon
Over Balmerserien ser du 4 pile dvs 4 spektrallinjer ved elektronspring til n=2.
Svar #3
14. december 2018 af hejmedjer1239
#2Over Balmerserien ser du 4 pile dvs 4 spektrallinjer ved elektronspring til n=2.
Altså, når atomet ikke får noget energi, så må elektronen jo være i grundtilstanden n = 1. Når den får energi, så kan elekrtonen kan den ende i mange "baner", men dem som giver os det synlige lys, er når elektronen emittere fra n2 til n1, n3 til n1 eller n3 til n2? Er det ikke sådan det skal forståes?
Svar #4
14. december 2018 af mathon
Altså, når atomet ikke får noget energi, så må elektronen jo være i grundtilstanden n = 1 er en forkert slutning.
Balmerserien handler netop om elektronspring fra et højere energiniveau til energiniveau 2.
Svar #5
14. december 2018 af Eksperimentalfysikeren
Det synlige lys kommer ved overgang fra n=3 til n=2, n=4 til n=2, n=5 til n=2 og n=6 til n=2.
De overgange, der går til n=1 giver alleultraviolet lys. Overgangene fra n højere end 6 til n=2 giver også ultraviolet lys, mens overgange til n større end 3 giver infrarødt lys.
Svar #6
15. december 2018 af hejmedjer1239
#5Det synlige lys kommer ved overgang fra n=3 til n=2, n=4 til n=2, n=5 til n=2 og n=6 til n=2.
De overgange, der går til n=1 giver alleultraviolet lys. Overgangene fra n højere end 6 til n=2 giver også ultraviolet lys, mens overgange til n større end 3 giver infrarødt lys.
TAK!!!!!!!!!!!!!
Men for at elektronen kan befinde sig i n=2, så skal den vel først have energi som har sparket den op fra n=1 til n=2 og så skal den igen absorpere en foton som så excitere den op til en højere energiniveau?
Svar #7
15. december 2018 af Eksperimentalfysikeren
Hvis fotonen har en energi, der svarer til afstanden mellem n=1 og n=5, kan springet ske direkte til n=5.
Ved de temperaturer, vi normalt har, vil langt de fleste brintatomer befinde sig i tilstanden n=1. Derfor vil man normalt kun se absorption fra n=1 til en af de højere tilstande.
I rummet omkring solen er der meget varmere og varmen bevirker, at der er brintatomer i højere tilstande, især n=2. Det bevirker, at det er er mange atomer, der kan absorbere fotoner, der svarer til overgangen n=2 til en højere tilstand. Derfor kan man se Balmerserien som absorptionslinier i solspektret.
Skriv et svar til: Spektrallinje for hydrogen - energiniveaudiagram
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.