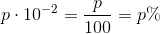Kemi
pH!
Nogen der kan hjælpe mig med denne opgave. Har selv prøvet at regnet lidt på det, men er meget i tvivl om jeg har gjort det rigtigt?
Beregn pH og [H3O+] i en 0,0100 M eddikesyre-opløsning.
pH = ½ *(pKs-logCs)à ½ *( 4,75-log(0,0100M)) = 6,75
Kseddikesyre= 10.pKs --> 10-4,75 = 0,000018M
[H3O+] = Ks*Cs --> 0,000018M*0,100M = 0,000002
b. Beregn derefter [CH3COO-] og [CH3COOH].
c. Beregn omdannelsesgraden.
d. Hvilken koncentration skal en HCl-opløsning have for at få samme pH-værdi som en 0,0100 M eddikesyre-opløsning ?
e.Husholdningseddike er en opløsning af eddikesyre i vand.
Masseprocenten af eddikesyre i husholdningseddike er 4,8 %.
Beregn husholdningseddikes pH-værdi, når densiteten af blandingen sættes til 1,0 g/mL.
Svar #1
16. oktober 2013 af mathon
pH = (1/2)•(pKs - log(cs)) = (1/2)•(4,75 - log(0,01)) = 3,4 (du glemte at gange med (1/2))
.
CH3COOH (aq) + H2O (l) <---> CH3COO- (aq) + H3O+ (aq)
ligevægtskoncentrationer (1 - α)•cs α•cs α•cs
[H3O+] = α•cs
hvor α - som vist i
https://www.studieportalen.dk/Forums/Thread.aspx?id=1393366
beregnes af
cs•α2 + Ks•α - Ks = 0
Svar #2
16. oktober 2013 af mathon
eller
[H3O+] = 10-pH = 10-3,4 = 4,0·10-4 M
b)
[CH3COO- ] = [H3O+] = 4,0·10-4 M
[CH3COOH] = cs - [CH3COO- ] = (1,0·10-2 M) - (4,0·10-4 M) = 9,6·10-3 M
c)
[CH3COO- ] 4,0·10-4 M
α = ----------------- = -------------- = 0,04 = 4%
cs 1,0·10-2 M
Svar #3
16. oktober 2013 af mathon
d. Hvilken koncentration skal en HCl-opløsning have for at få samme pH-værdi som en 0,0100 M eddikesyre-opløsning ?
c(HCl) = 10-pH = 10-3,4 = 0,00040 M
Svar #5
16. oktober 2013 af maikenC (Slettet)
Jeg er lidt i tvivl om e. Altså molariteten er den 1:1 eller?
Svar #7
18. oktober 2013 af mathon
e)
M(CH3COOH) = M(C2H4O2) = sum({2,4,2}*{12.011,1.008,15.999}) g/mol = 60.052 g/mol
c = p·10-2 • d/M = 4,8·10-2 • (1000 g/L) / (60,052 g/mol) = 0,80 M
pH i svag syre:
pH = (1/2)•(pKs - log(cs)) = 0,5•(4,75 - log(0,80)) = 2,4
Svar #9
07. marts 2016 af stdue (Slettet)
#7e)
M(CH3COOH) = M(C2H4O2) = sum({2,4,2}*{12.011,1.008,15.999}) g/mol = 60.052 g/molc = p·10-2 • d/M = 4,8·10-2 • (1000 g/L) / (60,052 g/mol) = 0,80 M
pH i svag syre:
pH = (1/2)•(pKs - log(cs)) = 0,5•(4,75 - log(0,80)) = 2,4
Hvorfor siger du 10^-2 ?
Skriv et svar til: pH!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.