Kemi
Beregn de aktuelle koncentrationer
SO2(g) + NO2(g) = SO3(g) + NO(g)
De fire gasser er i ligevægt i en lukket beholder med et volumen på 1,45L.
SO2 - - - 0,095mol
NO2 - - - 0,065mol
SO3 - - - 0,120mol
NO - - - 0,015mol
Jeg har fået Kc = 0,29
Spørgsmålet er; Beregn de aktuellte koncentrationer, når ligevægtsblandingen tilsættes 0,100mol NO2 uden volumen ændres. Anyone?
Svar #2
15. oktober 2015 af SifuSuna (Slettet)
Det har jeg også fået. Men i facit hæftet står der, at [SO2] = 0,0568M
Svar #3
15. oktober 2015 af mathon
Efter tilsætning af 0,100mol NO2 uden volumenændring:
Da - i dette specielle tilfælde - molbrøken og koncentrationsbrøken er identiske:
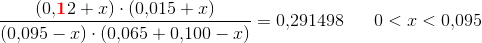
![\left [ SO_2 \right ]=\frac{(0{,}095-0{,}0126)\; mol}{1{,}45\; L}=0{,}0568\; M](https://media.studieportalen.dk/images/equations/lzCmaEC-xPIZ9AHcZJKXVg==.gif)
Svar #4
16. oktober 2015 af SifuSuna (Slettet)
Hvordan har du fået -0,0126? Når jeg løser det mht x, får jeg noget helt andet.
Skriv et svar til: Beregn de aktuelle koncentrationer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





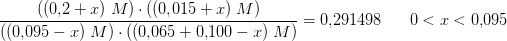
 SO3 (g) + NO (g)
SO3 (g) + NO (g)