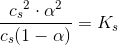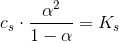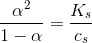Kemi
opløsning komplekser
Hej undskyld forstyrrelsen, jeg sidder med denne opgave og er lidt i tvivl hvordan jeg skal udregne 2'eren og 3'eren. Har ikke snakket så meget om komplekser endnu?? Og tak på forhånd.
1) Opskriv reaktionene for opløsningen af 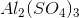 i vand:
i vand:
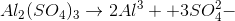
2) Hvad er koncentrationen af 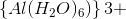 i en 0,1 M opløsning af
i en 0,1 M opløsning af 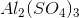 .
.
3)I litterature finder man 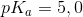 for
for 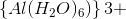 . Op skriv reaktionsligningen for den sure reaktion og beregn
. Op skriv reaktionsligningen for den sure reaktion og beregn 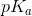 - værdien ud fra den målte pH.
- værdien ud fra den målte pH.
Svar #2
17. oktober 2015 af Ib2012 (Slettet)
Hvordan har du udregnet ligevægtsmolariteten, uden at vide hvad pKs er???
Svar #4
17. oktober 2015 af Ib2012 (Slettet)
Men hvorfor er det nu lige du dividere Ks med Cs i udtrykker ligevægtsudtrykket:
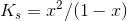
Skriv et svar til: opløsning komplekser
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



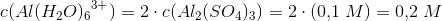
![[Al{(H_2O)_6}]^{3+}\, _{\textit{(aq)}}\; +\; H_2O\, _{\textit{(l)}}\; \rightleftharpoons \; [Al{OH(H_2O)_5}]^{3+}\, _{\textit{(aq)}}\; +\;H_3O^+\, _{\textit{(aq)}}](https://media.studieportalen.dk/images/equations/svDoskXxmfdieSzdbm6QDA==.gif)
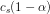
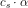
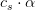
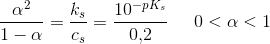
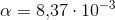
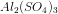 er
er ![[[Al{(H_2O)_6}]^{3+}]=(1-\alpha )\cdot c_s=(1-0{,}00837)\cdot (0{,}2\; M)=0{,}198\; M](https://media.studieportalen.dk/images/equations/utTdECHXohAs970p-HTjEA==.gif)
![pK_s\left ( \left [Al(H_2O)_6 \right ] ^{3+}\right )=4{,}85](https://media.studieportalen.dk/images/equations/jHwQZhYIeFr544UtwBlmEQ==.gif)
![\frac{\left [[Al{OH(H_2O)_5}]^{3+} \right ]\cdot \left [ H_3O^+ \right ]}{\left [\left [ Al{(H_2O)_6} \right ]^{3+} \right ]}=K_s](https://media.studieportalen.dk/images/equations/PJZETKB4c2Zqm-Eg-b1P9g==.gif)