Kemi
Varme
Ved at blande lithiumchlorid og natriumcarbonat dannes der ikke bundfald, men ved sætte opløsningen i et kogende vandbad, fældes lithium med carbonat. Hvordan skriver jeg et korrekt reaktionsskema for dette? Vil man sætte varme på som en reaktant, så der fås:
Li+(aq) + CO32-(aq) + varme ⇔Li2CO3 (s)
Eller skal man skrive varme over harpunpilen:
varme
2Li+(aq) + CO32-(aq) ⇔Li2CO3 (s)
Hvilken af disse måder er korrekte at skrive det på?
Svar #2
07. november 2015 af Lillyn
Mange tak for hjælpen! Hvis der tilsættes ammoniumchlorid i opløsningen, reagerer carbonat med ammonium og danner hydrogencarbonat, er dette reaktionsskema rigtigt afstemt:
2NH4+ (aq) + CO32- (aq) ⇔ 2NH3 (aq) + 2HCO3- (aq)
Skriv et svar til: Varme
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.









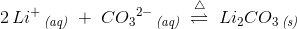
 NH3 (aq) + HCO3- (aq)
NH3 (aq) + HCO3- (aq)