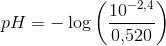Kemi
pH
17. november 2015 af
laborante (Slettet)
-
Niveau: Universitet/Videregående
HJÆLP
Beregn pH i følgende opløsninger bestående af:
a) 250 mL 0,0045 M KOH og 200 mL dem. vand
b) 400 mL 0,022 M HNO3 og 150 mL 0,055 M NaOH
c) 20 mL saltsyreopløsning (pH 2,4) fortyndes ad 500 mL dem. vand
Skriv et svar til: pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


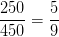
![[OH^-]=\frac{5}{9}\cdot (0{,}0045\; M)=0{,}0025\; M](https://media.studieportalen.dk/images/equations/vt0DcbGzlWtUj1ujZMxeLA==.gif)
![pH=14+\log([OH^-]/M)](https://media.studieportalen.dk/images/equations/6hU9otO9j2wG49oKMy-syA==.gif)
![[H_3O^+]=\frac{0{,}00055\; mol}{0{,}550\; L}](https://media.studieportalen.dk/images/equations/wvqpKKqfhoP9roS6KSi0Ew==.gif)
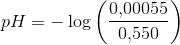
![[H_3O^+]=\frac{10^{-2{,}4}\; mol}{0{,}520\; L}](https://media.studieportalen.dk/images/equations/nBL-aA1V54HUYLSNmUXBtA==.gif)