Kemi
Opgaver
Hejsa, jg sidder med en opgave, som jeg forstår intet af. Jeg ved overhovedet ikke hvad jeg skal gøre. håber jeg kan få nget hjælp, tak på forhånd.
Jern(II)chlorid findes både med og uden krystalvand. De krystalvandholdige stoffer er FeCl2*2H2O og FeCl2*4H2?O.
a) Beregn masseprocenten af H2O i hvert af de to krystalvandholdige stoffer.
Et pulver vides at være enten FeCl2*2H2O eller FeCl2*4H2?O. Pulveret vejes, hvorefter krystalvandet forsigtigt uddrives. Efter at krystalvandet er fjernet, vejes pulveret igen. De to masser er henholdsvis 5,79g og 3,69g.
b) Hvilke af de to stoffer er der tale om?
Et grønligt pulver er en blanding af FeCl2 og FeCl2*2H2O. En analyse viser, at pulveret indeholder 37,4 masse% Fe.
c) Beregn masseprocenten af H2O i pulveret.
Svar #1
25. marts 2016 af mathon
masseprocenten af H2O i
FeCl2*2H2O:
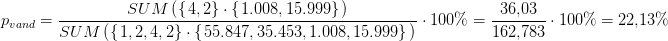
masseprocenten af H2O i
FeCl2*4H2O:
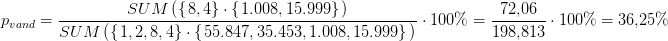
Svar #2
25. marts 2016 af mathon
b)
masse af krystalvand:
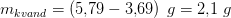
beregning af vandprocent:
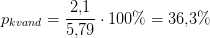
dvs.
pulveret er
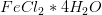
Svar #3
25. marts 2016 af mathon
c)
Beregn først masseforholdet mellem
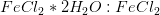 ud fra oplysningen
ud fra oplysningen
om Fe-procenten.
Beregn derefter H2O-procenten.
Svar #5
26. marts 2016 af mathon
Grundet
https://www.studieportalen.dk/forums/thread.aspx?id=1671426
Fe-procenter:
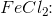
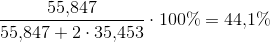
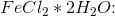
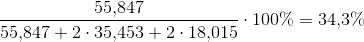
Med udgangspunkt i 100 g blanding af 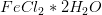 og
og 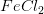
haves for
 gram
gram 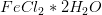 og
og 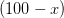 gram
gram 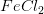
Fe-beregning:
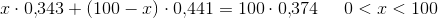
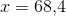
De 68,4 g 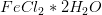 har et vandindhold på:
har et vandindhold på:
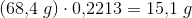
100 g blanding har et vandindhold på 15,1 g
Blandingens vandprocent er derfor 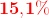
Skriv et svar til: Opgaver
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






