Kemi
Partialtryk
Hej alle sammen.
Jeg har problemer med følgende opgave:
"En vigtigt komponent i raketbrændstof er N2O4. Ved 25 grader celcius er det en gas der delvis dissocierer til NO2 .
Ved 25 grader celcius indstilles en ligevægt: N2O4 (g) <=> 2NO2 (g)
Ved ligevægt i en beholder på 3,00 liter er der 7,64 g N2O4 og 1,56 g NO2. Hvad er partialtrykket af NO2?
Håber nogen kan hjælpe :-)
Svar #1
13. november 2016 af OliverGlue
Det er to meget brugte sammenhænge, du skal bruge...
Svar #2
13. november 2016 af mathon
Beregn først
antal mol af hver gas.
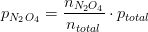 partialtrykket er molbrøken af totaltrykket
partialtrykket er molbrøken af totaltrykket
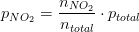
Svar #3
13. november 2016 af Jenskristiann
Jeg forstår bare ikke, hvordan man kan regne det, når ikke får opgivet Ptotal?
Svar #4
13. november 2016 af OliverGlue
Hvorfor betragter du begge gasser? For NO2 skriver du også
p_NO2 = (n_NO2/n_total)*(n_total*k) = n_NO2*k
hvor k er R*T/V.
Svar #5
13. november 2016 af OliverGlue
Du skal fuldstændig instinktivt kunne omregne en masse af et stof til en stofmængde, og så trykket ved et bestemt V og T.
Hint:
Ideal gas
Svar #7
13. november 2016 af OliverGlue
Svar #9
13. november 2016 af Jenskristiann
Tusinde tak for hjælpen til jer begge.
Jeg har lige prøvet at sætte mig ind i idealgasligningen, og jeg forstår det fuldt ud :-)
Takker endnu en gang!
Skriv et svar til: Partialtryk
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


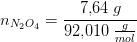
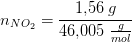
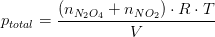
![p_{NO_2}=\left [ NO_2 \right ]\cdot R\cdot T](https://media.studieportalen.dk/images/equations/dZ1QzqmTNOXEkOPWxrPP4Q==.gif)