Kemi
Reaktionsskema
Opskriv reaktionsskema mellem citronsyre og vand.
Jeg ved godt dette er et simpelt spørgsmål men er der nogen der kan hjælpe?
Svar #1
04. oktober 2017 af mathon
Citronsyre er en trihydron syre 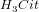
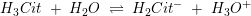 pKs1 = 3,2
pKs1 = 3,2
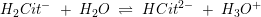 pKs2 = 4,76
pKs2 = 4,76
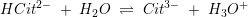 pKs3 = 6,4
pKs3 = 6,4
Svar #4
04. oktober 2017 af calliemoore (Slettet)
Hvordan opskriver man så reaktionskemaet mellem phosphorsyre og vand? og at opskrive reaktionsbrøken
Svar #6
04. oktober 2017 af calliemoore (Slettet)
Jeg forstår ikke hvor du får tallene fra i reaktionsbrøken
Svar #9
04. oktober 2017 af mathon
Phosphorsyre er en trihydron syre 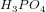
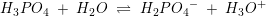 pKs1 =2,2
pKs1 =2,2
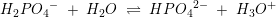 pKs2 =7,2
pKs2 =7,2
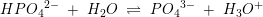 pKs3 = 12,2
pKs3 = 12,2
Svar #10
04. oktober 2017 af calliemoore (Slettet)
Men jeg forstår stadig ikke hvordan du beregner tallet i reaktionsbrøken, altså hvor kommer 6,31 fra?
Skriv et svar til: Reaktionsskema
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





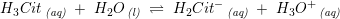
![\small \frac{\left [ H_2Cit^- \right ]\cdot \left [ H_3O^+ \right ]}{\left [H_3Cit \right ]}=6{.}31\cdot 10^{-4}\; M](https://media.studieportalen.dk/images/equations/Uklfpbh27NEaICxJkEky5Q==.gif)
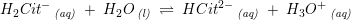
![\small \frac{\left [ HCit^{2-} \right ]\cdot \left [ H_3O^+ \right ]}{\left [H_2Cit^- \right ]}=1{.}74\cdot 10^{-5}\; M](https://media.studieportalen.dk/images/equations/XMO2xqDsuMfagJcqeKCz3A==.gif)
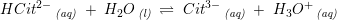
![\small \frac{\left [ Cit^{3-} \right ]\cdot \left [ H_3O^+ \right ]}{\left [HCit^{2-} \right ]}=3{.}98\cdot 10^{-7}\; M](https://media.studieportalen.dk/images/equations/XLSTRtxrueyPvVWoCPQQ-Q==.gif)
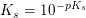
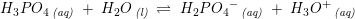
![\small \frac{\left [ H_2P{O_4}^- \right ]\cdot \left [ H_3O^+ \right ]}{\left [H_3P{O_4} \right ]}=6{.}31\cdot 10^{-3}\; M](https://media.studieportalen.dk/images/equations/N3oSaG_qB440B9OPrv8_Lg==.gif)
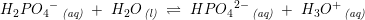
![\small \frac{\left [ HP{O_4}^{2-} \right ]\cdot \left [ H_3O^+ \right ]}{\left [H_2P{O_4}^- \right ]}=6{.}31\cdot 10^{-8}\; M](https://media.studieportalen.dk/images/equations/kVLuFYZI13wJhOHwd1oSXA==.gif)
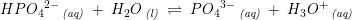
![\small \frac{\left [ P{O_4}^{3-} \right ]\cdot \left [ H_3O^+ \right ]}{\left [HP{O_4}^{2-} \right ]}=6{.}31\cdot 10^{-13}\; M](https://media.studieportalen.dk/images/equations/MS6W35HhBkR6prp3vGx5VA==.gif)
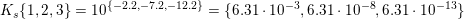
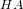 ved 25°C:
ved 25°C: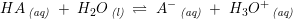
![\small \frac{\left [ A^- \right ]\cdot \left [ H_3O^+ \right ]}{\left [ HA \right ]}=K_s](https://media.studieportalen.dk/images/equations/U-TG-IzEW28Cla1dDfW9jQ==.gif)
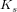 betyder noget:
betyder noget: