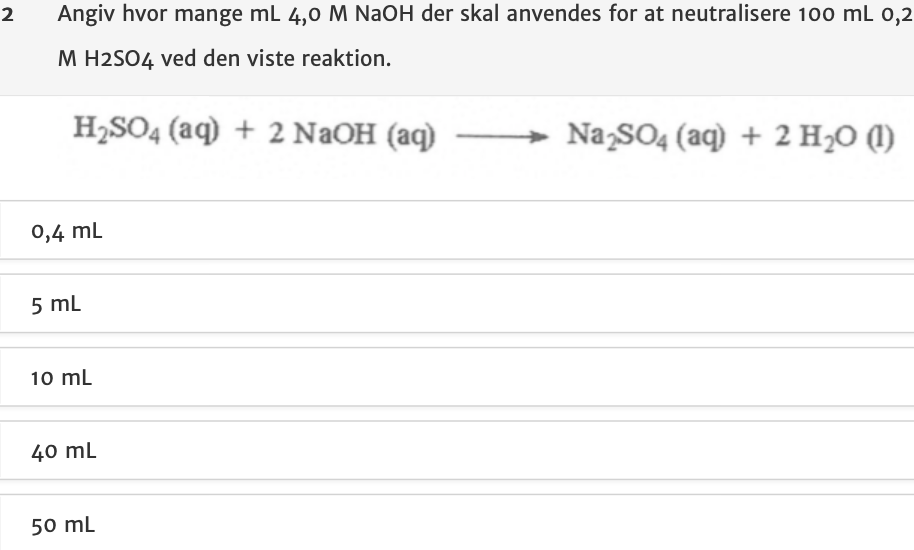Kemi
Hjælp hvor mange gram kulstof?
Hvordan regner jeg opgaven på vedhæftede billede?
Jeg ved godt hvad facit er, men hvordan kommer jeg frem til det. Er der en formel, som jeg kan bruge eller en specifik fremgangsmåde, som jeg altid kan brruge i lign. opgaver?
Svar #6
06. august 2019 af BlopBlip
mathon bruger ligningen:
Hvor n er "antal mol" (stofmængden), m er massen og M er molmassen (findes i det periodiske system).
Man starter med at udregne stofmængden af SiO2 og da man kender forholdet mellem SiO2 og C kan man "oversætte" stofmængden af SiO2 til stofmængden af C, herefter findes molmassen og man kan nu bruge ligningen ovenover dog skal den lige ændres til:
Svar #7
07. august 2019 af Lara45
#6 Tusind tak. Det er lige præcis sådan en forklaring jeg havde brug for.
Jeg sidder med en anden opgave (vedhæftet) og jeg ved ikke hvilken formel jeg kan bruge.
Er der nogle, der kan fortælle mig, hvordan jeg kan løse denne opgave?
På forhånd tak
Skriv et svar til: Hjælp hvor mange gram kulstof?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.