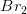Kemi
Ligevægt
Hej!
Jeg er igang med at svare på nogle spørgsmål i kemi, og sidder lidt i klemme. Jeg skal beregne ligevægtskonstanten ved 500K (jeg har 1,00 mol dihydrogen, 1,20 mol diiod i en tom beholder, med et rumfang på 5,00 L - beholderen termostateres ved 500 K, og når der er indtrådt ligevægt i systemet, måles koncentrationen af hydrogeniodid til 0,364 M)
Hvad gør jeg? Jeg har en vejledning ved siden af mig, men der er ikke de bedste forklaringer til , hvilket ikke hjælper særlig meget /:
På forhånd tak!
Svar #2
24. januar 2010 af Jullelo (Slettet)
Tak for det :) - hvad med denne her? :
For ligevægten 2 NOBr (g) 2 NO (g)+Br2(g) ER k=1,6*10^-3M ved 25 graders celcius. 0,0200 mol NOBr (nitrosylbromid) spærres inde i en beholder med et rumfang på 1,00 L, der termostateres ved 25 graders celcius.
Beregn koncentrationerne af NOBr, NO og Br2, når ligevægten er indtrådt.
Svar #3
24. januar 2010 af Gate2 (Slettet)
Jeg tør ikke give dig et svar på det, - har et hul i min viden, men prøv at spørge mathon - han kan helt sikkert give dig et forståeligt svar (så kan jeg måske også lære noget)
Svar #4
24. januar 2010 af mathon
2 NOBr (g) <---> 2 NO (g) + Br2 (g)
ækvivalente stofmængder
før ligevægt 0,0200 0 0
i ligevægt 0,0200-2x 2x x x<0,0100
ligevægtsloven
[NO]2·[Br2]/[NOBr]2 = 1,6·10-3 M
(2x)2·x/(0,0200-2x)2 = 1,6·10-3 M
x3/(x-0,01)2 = 0,0016 0<x<0,0100
x = 0,003903
ligevægtskoncentrationer ved 25ºC
da fællesvoluminet er netop 1,00 L
NOBr NO Br2
0,0200-2x = 0,0122 M 2x = 0,00781 M x = 0,00390 M
Svar #5
24. januar 2010 af Jullelo (Slettet)
Gør man så det samme ved denne? :
For ligevægten PCI5(g) <-> PCI3(g)+Cl2 (g) er K=46,9 M ved 700 K. 10,0 g PCI5 spærres inde i en tom beholder hvis rumfang er 2,50 L. Temperaturen holdes konstant på 700 K.
Beregn koncentrationerne af PCI5, PCI3 og Cl2, når ligevægten er indtrådt.
Svar #6
24. januar 2010 af Jullelo (Slettet)
Jeg forstår nemlig ikke helt metoden /: - kan du forklare lidt dybere?
Svar #7
24. januar 2010 af mathon
n(PCI5) = (10,0 g)/(208,24 g/mol) = 0,048022 mol
PCI5 (g) <---> PCI3 (g) + Cl2 (g)
ækvivalente stofmængder
før ligevægt 0,04802 0 0
i ligevægt 0,04802-x x x 0<x<0,04802
ligevægtsloven
[PCI3]·[Cl2]/[PCI5] = 46,9 M
x·x/(0,04802-x) = 46,9 M
x2/(0,04802-x) = 46,9 0<x<0,04802
x = 0,047972
ligevægtskoncentrationer ved 700ºK
PCI5 PCI3 Cl2
((0,04802-x)mol)/(2,5 L) = 1,963·10-5 M (x mol)/(2,5 L) = 0,019189 M (x mol)/(2,5 L) = 0,019189 M
Svar #8
24. januar 2010 af mathon
let redigering
n(PCI5) = (10,0 g)/(208,24 g/mol) = 0,048022 mol
PCI5 (g) <---> PCI3 (g) + Cl2 (g)
ækvivalente stofmængder
før ligevægt 0,04802 0 0
i ligevægt 0,04802-x x x 0<x<0,04802
ligevægtsloven
[PCI3]·[Cl2]/[PCI5] = 46,9 M
(x/2,5)·(x/2,5)/(0,04802-x)/2,5 = 46,9 M
-0,4x2/(x-0,04802) = 46,9 0<x<0,04802
x = 0,048
ligevægtskoncentrationer ved 700ºK
PCI5 PCI3 Cl2
((0,04802-x)mol)/(2,5 L) = 8·10-6 M (x mol)/(2,5 L) = 0,0192 M (x mol)/(2,5 L) = 0,0192 M
Svar #11
25. januar 2010 af mathon
...fordi ligevægtsloven handler om koncentrationer og ikke om stofmængder
i den foregående opgave var fællesvoluminet netop 1 L,
hvorfor stofmængdetal = koncentrationstal,
hvilket ikke er tilfældet her.
Svar #12
08. oktober 2016 af hejmeddigvenner (Slettet)
#42 NOBr (g) <---> 2 NO (g) + Br2 (g)
ækvivalente stofmængder
før ligevægt 0,0200 0 0
i ligevægt 0,0200-2x 2x x x<0,0100
ligevægtsloven
[NO]2·[Br2]/[NOBr]2 = 1,6·10-3 M(2x)2·x/(0,0200-2x)2 = 1,6·10-3 M
x3/(x-0,01)2 = 0,0016 0<x<0,0100x = 0,003903
ligevægtskoncentrationer ved 25ºC
da fællesvoluminet er netop 1,00 L
NOBr NO Br2
0,0200-2x = 0,0122 M 2x = 0,00781 M x = 0,00390 M
Hej,
Jeg ved at det er et gammelt indlæg, men nogle som evt. kan forklare mig hvorfor der er indsat et -2x ved start NOBr?
Svar #15
09. oktober 2016 af hejmeddigvenner (Slettet)
Skriv et svar til: Ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




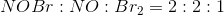
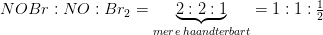
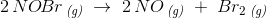
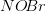 ækvivalerer 2 mol
ækvivalerer 2 mol 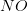 og 1 mol
og 1 mol