Kemi
reaktionshastigheden
Grafen øverst på siden viser den aktuelle koncentration af hydrogenperoxid som funktion af tiden for et eksperiment i en vandig opløsning af H2O2. opløsningen er på et givet tidspunkt tilsat en katalysator, hvorefter følgende spaltningsreaktion har fundet sted:
2H2O2(aq)--> 2H2O (l)+ O2(g)
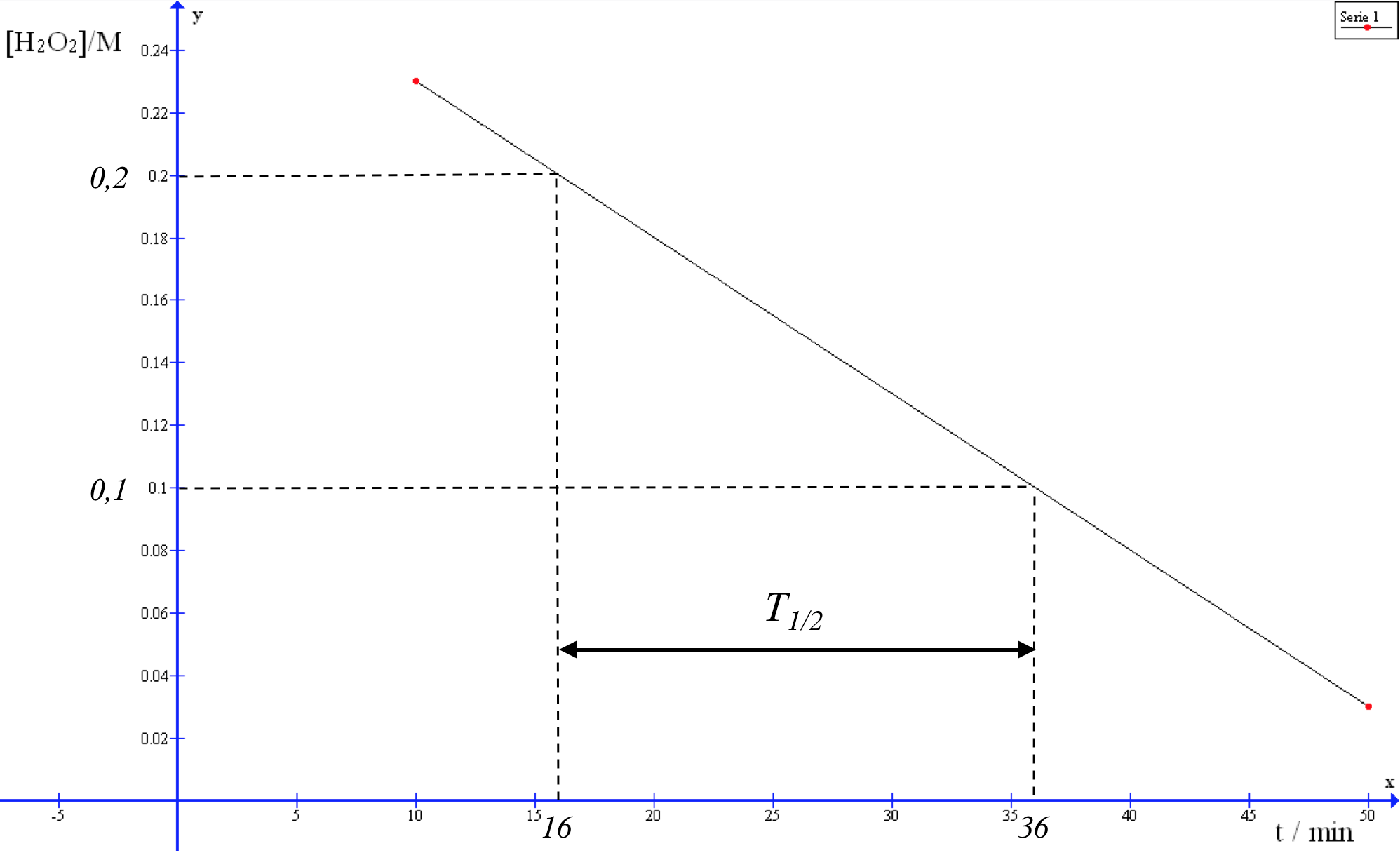
Bemærk at 2aksen er logaritmisk
a) Forklar, at reaktionen er af første orden
b) Bestem halveringstiden så præcist som muligt ud fra grafen
c) Beregn en værdi for hastighedskonstanten
d) Beregn reaktionshastifheden til tiden 45min
e) Beregn det tidspunkt, hvor reaktionshastigheden er 1,2•10-5M/S
Svar #2
17. januar 2019 af Soeffi
#0. Svar: (k mangler at blive beregnet)
a) Den giver en ret linje i et semilogaritmisk plot
b) Som det fremgår af grafen nederst tager det 20 min. at komme fra 0,2 M til 0,1 M.
Dvs. halveringstiden eller T1/2 er 20 min. = 1200 s.
c) k = ln(2)/T1/2
d) v(45) = k·[H2O2](45) = k·(0,055 M) (aflæses af kurven)
e) v(t) = 1,2•10-5 M/s ⇒ k·[H2O2](t) = 1,2•10-5 M/s ⇒ [H2O2](t) = (1,2•10-5 M/s)/k.
Når [H2O2](t) kendes kan t aflæses af kurven
Skriv et svar til: reaktionshastigheden
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

